Hilfe bei Stöchiometrie Volumen?
Die Aufgabe lautet:
Bestimme das Volumen an Sauerstoff, das aus 1ml Wasserstoffperoxid (H2O2) unter Normalbedingungen entsteht (wenn es in H2O und O2 zerfällt).
Ich bin mir bei meiner Lösung nicht sicher, ob das richtig sein kann, da es zu einfach wäre. Auch Chat GPT hat etwas anderes raus, jedoch hat er nicht die Formel verwendet wie ich, weshalb ich seinen Weg nicht verstehe.
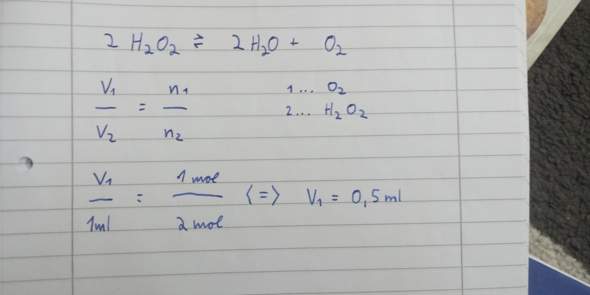
2 Antworten

emm, Deine Lösung ist leider falsch!
Obwohl die Reaktionsgleichung richtig und wichtig ist, hast Du zwei Dinge nicht bedacht!
Sauerstoff ist ein Gas! Und um ein Gasvolumen zu bestimmen braucht man die Stoffmenge, wobei 1 ml NICHT auch 1 mol ist!

Du hast 1 ml H₂O₂ — vermutlich ist 100% H₂O₂ gemeint, das ist aber wegen seiner Explosivität keine Standardchemikalie im Labor. Ich ignoriere diese Komplikation und tue so, als ob die Substanz tatsächlich handelsüblich wäre.
Die Dichte von H₂O₂ beträgt ρ=1.45 g/ml (muß man im Internet nachschlagen, weil es träflicherweise nicht in der Angabe steht). Also haben wir n=m/M=0.0426 mol H₂O₂, und daraus entsteht halb soviel O₂:
2 H₂O₂ ⟶ 2 H₂O + O₂
Letztlich wollen wir also wissen, welches Volumen 0.0213 mol O₂ (oder irgendein anderes Gas) einnehmen, und zwar bei T = 0 °C = 273.15 K und p=101325 Pa. Dazu setzt man in die Gasgleichung ein, beachtet die Einheiten und fertig:
pV = nRT ⟹ V = nRT/p = 478 ml

Ich weiß auch nicht,was Schulen an den frostigen Normalbedingungen so cool finden. Aber wenn es so dasteht, dann muß man wohl damit rechnen.

Danke !!!!! und nee im buch steht so 10ml von 10% lösung, hab das einfach direkt umgerechnet

Das ist tatsächlich nur sehr näherungsweise richtig:
- Die Dichte von w=10% H₂O₂ in H₂O beträgt nämlich nur ρ=1.035 g/ml. Also wiegen 10 ml davon 10.35 g, und 10% davon sind 1.035 g.
- Dagegen wiegt 1 ml 100%iges H₂O₂ wie oben erklärt 1.45 g, das ist ungefähr 40% mehr.
- Aus 1.035 g H₂O₂ entwickeln sich ein 0 °C und 101325 Pa V=nRT/p=341 ml O₂

Bei Dir im Labor ist es immer ganz schön kalt...ich nehm immer 24 L/mol...lässt sich auch schön einfach berechnen...