(Elektro)Chemie und PH-Wert berechung?
Hallo!
Kann mir vielleicht jemand in Chemie helfen? Ich verstehe nicht wie ich anfangen soll und allgemein das Thema ist wirklich schwer verständlich für mich ._.
a)Bestimmen Sie den pH-Wert einer Natronlauge der Konzentration 1 · 10 –8 mol /l.
b) • Beschreiben Sie mit einer Wort- und einer Reaktionsgleichung die Salzbildung aus Phosphorsäure und Kalkwasser.
• Berechnen Sie die zur Herstellung von 250 g Calciumphosphat notwendigen Massen an Phosphorsäure und Calciumhydroxid.
c) 0,72 g HCl-Gas werden in 200 ml Wasser gelöst. Berechnen Sie die Konzentration der Lösung in g/l, mol /l und den pH-Wert.
Danke sehr!<3
1 Antwort

Um den pH-Wert einer starken Lauge auszurechnen, braucht man gewöhnlich nur die gegebene Konzentration zu logarithmieren. In diesem Fall ist es jedoch etwas komplizierter, weil die Verdünnung so groß ist:
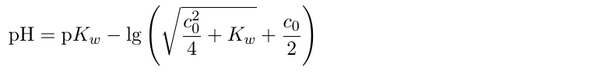
Dabei ist c₀=10⁻⁸ mol/l, Kw ist die Wasserkonstante ≈10⁻¹⁴, und pKw≈14. Das Ergebnis ist pH=7.02, liegt also nur einen winzigen, unbedeutenden Hauch über „neutral“.
2 H₃PO₄ + 3 Ca(OH)₂ ⟶ 3 H₂O + Ca₃(PO₄)₂
250 g Calciumphosphat sind n=m/M=0.806 mol. Man braucht also die doppelte Stoffmenge (n=1.61 mol) Phosphorsäure (entspricht m=n⋅M=158 g) und die dreifache Stoffmenge Calciumhydroxid (n=2.42 mol und m=n⋅m=179 g).
0.72 g HCl-Gas in 200 ml entspricht einer Massenkonzentration von γ=m/V=3.6 g/l, das kann man als Stoffmengenkonzentration c=γ/M=0.099 mol/l bzw. einem pH-Wert von pH=−lg(c)=1.01
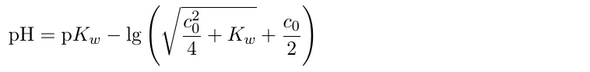

In die Formel gehört ein Plus statt eines Minus vor dem Logarithmus. Fipptehler.