DEACON-Prozess - Druck und Temperatur?
Herstellung Chlor: Chlorwasserstoff und Sauerstoff durch Kupfer(II)chlorid als Katalysator in GG-Reaktion bei 400°C umgesetzt, Nebenprodukt: H2O
4HCl + O2 <-> 2 Cl2 + 2H2O
Wie kann durch Veränderung des Drucks und der Temperatur die Ausbeute an Chlor erhöht werden? Wie verändert sich der Wert der Gleichgewichtskonstante?
Ich würde sagen, dass sich die Gleichgewichtskonstante bei Temperaturändering nicht ändert (weiss aber nicht wieso),bei Druck jedoch schon (:/)
Hmm...woher weiss ich denn das :/
3 Antworten

Die Gleichgewichtskonstante ist von der Temperatur abhängig;
Beim Druck ändert Sie sich auch;
du kannst das z.B. mit dem Prinzip vom kleinsten Zwang erklären

beim Druck, wenn HCl flüssig ist, dann verschiebt sich das Gleichgewicht nach links, da dann weniger Gasmoleküle vorliegen und das den Druck erniedrigt
also müsste der Druck erniedrigt werden um mehr Cl2 zu erhalten unter der Voraussetzung das HCl flüssig ist

Danke! Mir ost klar: die Reaktion ist endotherm, das heisst eine Temperatureehöhung verschiebt das GG auf die Produktseite, K wird grösser.
Man könnte den Druck erhöhen, dann würde sich das GG nach rechts verschieben, Kc wird grösser
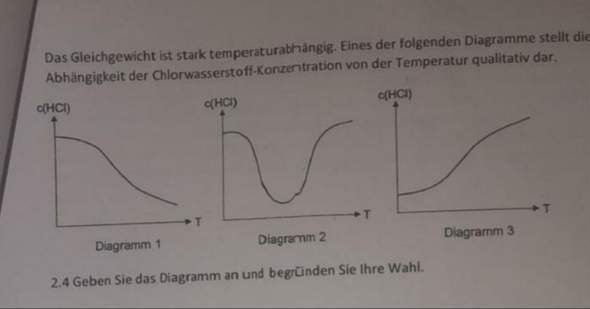
Welches Diagramm würden Sie zuordnen und wieso?

Wenn die Reaktion endotherm ist, verschiebt sich bei Temperaturerhöhung das GW nach rechts, also ist nimmt die c von HCl ab und somit Diagramm 1

Wenn die Reaktion endotherm ist, verschiebt sich bei Temperaturerhöhung das GW nach rechts, also ist nimmt die c von HCl ab und somit Diagramm 1(K wird größer)
das mit dem Druck stimmt dann auch, da bei 400Grad alles gasförmig ist


Bei 400 °C liegen sämtliche Komponenten als Gas vor. Wenn Du aus 5 Molekülen Edukt 4 Moleküle Produkt bildest, nimmt der Druck ab.
Bei der Temperatur gilt als Faustregel: Wenn die Reaktion endotherm ist, liegt das Gleichgewicht bei höherer Temperatur auf Seiten der Produkte. und vice versa.
Also recherchiere, ob exo- oder endotherm.

Danke! Mir ost klar: die Reaktion ist endotherm, das heisst eine Temperatureehöhung verschiebt das GG auf die Produktseite, K wird grösser.
Man könnte den Druck erhöhen, dann würde sich das GG nach rechts verschieben, Kc wird grösser
Welches Diagramm würden Sie zuordnen und wieso?

> das heisst eine Temperatureehöhung verschiebt das GG auf die Produktseite
Und steigt oder fällt dadurch die HCl-Konzentration?
Und wenn Du das richtig beantworten kannst - wo ist dann Dein Problem mit den Diagrammen?

Weil mich der Verlauf verwirrt.:/welches würden Soe zuordnen und wieso...hier wurde einmal Diagramm 1 und Diagramm 3 geschrieben hmm

> Weil mich der Verlauf verwirrt
Du hattest bereits erkannt "eine Temperatureehöhung verschiebt das GG auf die Produktseite". Damit kannst Du auch beantworten "steigt oder fällt dadurch die HCl-Konzentration?"
Bei einem Diagramm steigt und bei einem sinkt die HCl-Konzentration mit zunehmender Temperatur. Damit ist die Auswahl doch klar, passend zur Antwort.
Diagramm 2 käme nur dann in Frage, wenn 2 gegenläufige (zumindest in Bezug auf die HCl-Bildung oder -Verbrauch) Reaktionen stattfänden, eine bei niederen und eine zweite bei hohen Temperaturen.

Es reagieren 5 Moleküle zu 4 Molekülen. Also nimmt die Entropie ab. Also liegt mit zunehmender Temperatur das Gleichgewicht auf der linken Seite. Also trifft Diagramm 1 zu.


Upps, ich hab nicht richtig hingesehen und gedacht die Konzentration von Cl2 wäre angeben. Diagramm 3 ist also richtig.
Ja danke, wie würden Sie es in dem Fall erklären?