Aufstellen von Valenzstrichformeln: Vorgehen?
Ich verstehe einfach nicht, wie man vorgeht wenn ich zum Beispiel die Valenzstrichformel von Schwefelsäure aufstellen muss. (H2SO4) ich hätte es jetzt so aufgestellt
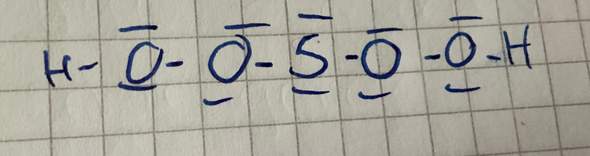
hab aber im Internet nachgeschaut, dass es falsch ist. Wie kommt man da drauf?
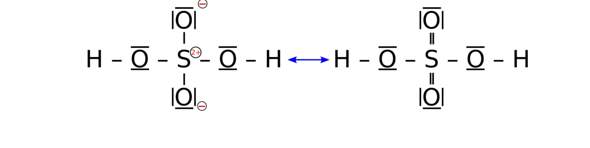
2 Antworten

Die naheliegende Vermutung in solchen Fällen ist, daß sich die Sauerstoffatome um das schwere Atom im Zentrum herum anordnen, z.B. H₃PO₄, HClO₄, und daß etwaige H-Atome am O hängen. Natürlich kann man mit dieser Vermutung auch einmal Schiffbruch erleiden, aber das sollte der erste Versuch sein; wenn es nicht klappt (z.B. bei der Thioschwefelsäure H₂S₂O₃, da ist ein S-Atom in der Mitte und ein zweites wie die Sauerstoffe am Rand), dann muß man vermutlich nachlesen.

Bei einem so kleinen Molekül eigentlich ganz simpel. Schwefelsäure ist aber doch etwas komplizierter. Du hast das insofern schon richtig gemacht, als dass du auf die Anzahl an Valenzelektronen und die Oktettregel geachtet hast.
Allerdings muss man hier auch bedenken, dass Peroxide (also R-O-O-R Verbindungen) nicht stabil sind. Da du aber weißt, dass H2SO4 stabil ist, müssen alle O am S hängen.

ok danke