Aufgabe zur Titration?
Der saure Geschmack des Rhabarbers wird durch die zweiprotonige Oxalsäure (H2C2O4) hervorgerufen. Eine Probe von 50 ml Rhabarbersaft wird mit Natronlauge (c=1mol/l) titriert. Es werden 19,5 ml Natronlauge verbraucht. Ermittle die Stoffmengenkonzentration der Oxalsäure im Rhabarbersaft.
Kann mir jemand dabei helfen?
2 Antworten

H₂C₂O₄ + 2 NaOH ⟶ Na₂C₂O₄ + 2 H₂O
Dein Verbrauch von V=19.5 ml entspricht einer Stoffmenge von n=cV=19.5 mmol NaOH, diese haben mit halb so viel also 9.75 mmol Oxalsäure reagiert, also waren in den 50 ml Rhabarbersaft 9.75 mmol Oxalsäure drin, also c=n/V=0.195 mol/l.
Das entspricht einer Massenkonzentration von γ=17.6 g/l; das erschent mir absurd hoch, ich würde eher etwas in der Preisklasse von grob ≈1 g/l erwarten. Entgegen dem, was in Deinem Text steht, verdankt Rhabarber nämlich seinen sauren Geschmack vor allem der Äpfelsäure; die Oxalsäure ist nur in kleinen Mengen enthalten und trägt nicht viel zum Geschmack bei.
Als kleinen Bonus gibt es hier noch eine Titrationskurve für Deine Bestimmung (unter der Annahme, daß Du wirklich eine Oxalsäurelösung titrierst). Du siehst, daß anfangs im Kolben hauptsächlich Oxalsäure (roter Hintergrund) und Hydrogenoxalat (purpur) vorliegen, und im Lauf der Titration verschwindet zurst die Oxalsäure, und dann bildet sich Oxalat (blau). Der pH (schwarze Kurve) zeigt am ersten Äquivalenzpunkt (9.75 ml) einen kleinen Sprung, aber der ist nicht hoch genug, um mit einem Indikator scharf sichtbar gemacht zu werden. An der Graphik kannst Du auch gut erkennen, welche Indikatoren für die Titration geeignet sind, nämlich alle, die im Bereich von ≈6–11 umschlagen.
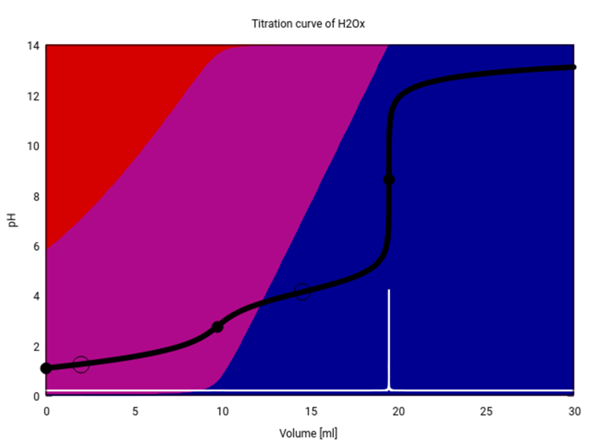
Edit: Ich habe nochmals nachgelesen; der Gesamtsäuregehalt von Rhabarbersaft wird in der Literatur grob zwischen 15 und 18 g/l angegeben (berechnet als Äpfelsäure); Dein Resultat würde, wenn man Äpfelsäure zugrundelegt, rund 26 g/l entsprechen. Es sieht so aus, als ob da mehrere Fehler zusammengekommen sind.
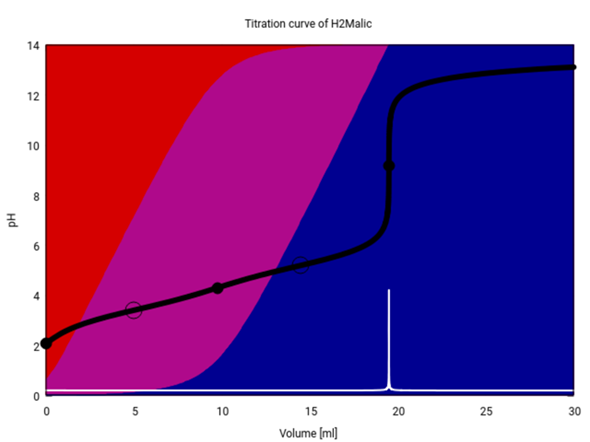
Die Titrationskurve für Äpfelsäure sieht übrigens ein bißchen anders aus, weil Äpfelsäure schwächer als Oxalsäure ist, also weniger stark dissoziiert (daher gibt es mehr Rot im Hintergrund), und außerdem ist von der ersten Stufe in der Titrationskurve gar nichts zu sehen.
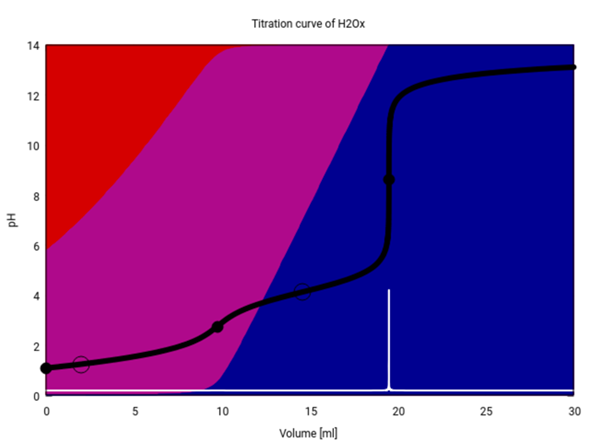
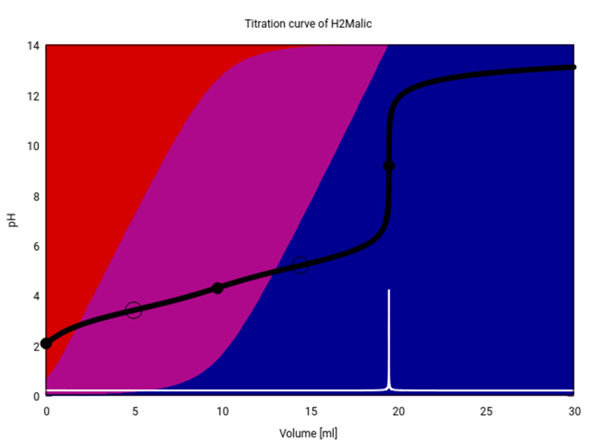

Du rechnest aus, welche Stoffmenge n an NaOH bei der Titration verbraucht wurde. Die Stoffmenge an Oxalsäure ist genau halb so groß, weil 1 Säuremolekül mit 2 Säurefunktionen 2 NaOH verbraucht.
nOxals. = 2 nNaOH
Dann nur mit c = n/V die Konzentration berechnen.