Ich unterstütze nicht aktiv, aber ich respektiere diese Personen. Es sind auch Menschen, sie haben einfach andere sexuelle Ansichten.
Das einzige, was ich absolut nicht unterstütze und auch nicht respektieren kann sind Leute, die sich als ein Tier identifizieren! Das versteh ich nicht mal, also wie kann man denn an einem Tag aufstehen und sagen „ja ab jetzt bin ich ein Hund und will auch so behandelt werden.“ häää
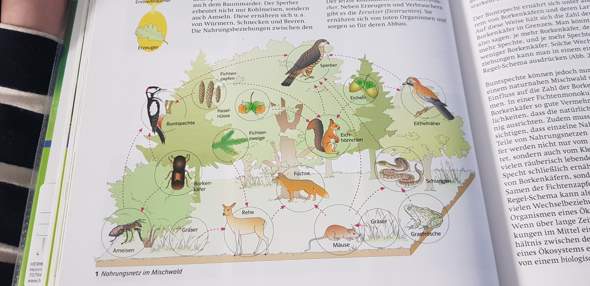
Das ist zwar ein Nahrungsnetz aber man kann einzelne Nahrungsketten daraus ablesen.
Also du könntest es auch mit den Valenzelektronen versuchen. Diese erkennt man an der Nummer der Hauptgruppe im Periodensystem, denn beide sind identisch (z.B. Sauerstoff -> Hauptgruppe VI -> 6 Valenzelektronen).
Jetzt musst du trotzdem die Oktettregel im Hinterkopf behalten. Z.B. wieder Sauerstoff, das will lieber 8 Valenzelektronen anstatt 6 haben. Also verbindet es sich mit anderen Atomen. Z.B. könnte es sich mit Kalium verbinden, aber das hat nur 1 Valenzelektron, also würden das Sauerstoffatom mit dem Kaliumatom nur 7 Valenzelektronen haben. Deswegen verbindet sich das Sauerstoffatom gleich mit 2 Kaliumatomen, nun haben sie zusammen 8 Valenzelektronen (& die Oktettregel ist erfüllt).
Die Kaliumatome haben also jeweils ihr Valenzelektron abgegeben und damit die Edelgaskonfiguration von Argon erreicht. Und das Sauerstoffatom hat 2 Valenzelektronen dazubekommen und somit die Edelgaskonfiguration von Neon erreicht.
Das geht natürlich auch mit anderen Partnern, z.B. könnte sich 1 Sauerstoffatom auch mit 1 Magnesiumatom (II. Hauptgruppe -> 2 Valenzelektronen) verbinden und sie hätten beide die Edelgaskonfiguration mit 8 Valenzelektronen erreicht.
Ein Atom kann also unterschiedlich viele und andere Bündnispartner haben, aber es müssen am Ende immer bei jedem Atom 8 Valenzelektronen vorhanden sein, also musst du einfach schauen, welchen Stoff du hast und wie viele Valenzelektronen dieser noch benötigt oder abgeben muss um 8 Elektronen auf der letzten Schale zu haben. Und je nachdem wie viele das sind, suchst du ein passendes Atom, das entweder selber genauso viele Elektronen wie benötigt abgeben kann oder die Abgegebenen selber aufnehmen kann.
Ich hoffe, ich habe das einigermaßen verständlich erklärt.