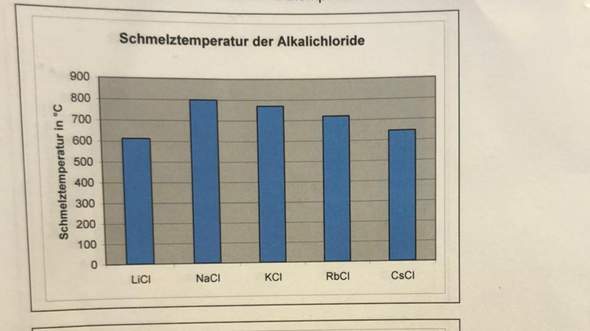
Warum hat NaCl eine höhere Schmelztemperatur als LiCl?
Mein Gedankengang ist folgendermaßen:
Li hat einen geringeren Ionenradius als Natrium. Beide Verbindungen sind einfach geladen. So hat LiCl doch laut dem coloumbschen Gesetz eine höhere Gitterenergie als NaCl, oder? Höhere Gitterenergie = Höhere Stabilität = Höherer Schmelzpunkt
Jedoch warum hat NaCl eine höhere Schmelztemperatur als LiCl