Woran erkenne ich bei einer Redoxreaktion, welcher Stoff reduziert und welcher Stoff oxidiert wird?
4 Antworten

Wenn du es nicht auf den ersten Blick erkennst, weil du das Beispiel so oder so ähnlich schon kennst ...
... dann musst du wohl oder übel die Oxidationszahlen aller beteiligten Atome bestimmen und prüfen, ob sich welche ändern.
Das machern Experten nicht anders, die haben nur sehr viel mehr an Wissen gespeichert, sodass sie seltener OZ bestimmen.
Wenn du das mit den OZ nicht verstehst, musst du es lernen.
Ohne die geht es nicht.

Das geht mit einem ganz kleinen Trick. Wenn du den kannst, hast du es innerhalb weniger Minuten raus :-)
Redoxreaktion (Reduktion: OxZ ↓ Oxidation OxZ ↑)
OxZ = Oxidationszahl
Oxidationszahlen kannst du bestimmen oder?
In dem Anhang findest du ein Bild:
Cu ist meistens +II (wird aber angegeben)
O2 ist Sauerstoff und bekommt immer -II (musst du anhand der Hauptgruppen schauen wie viel Elektronen ab-bzw die Elemente aufnehmen)
Das H2 und Cu bekommen beide 0, weil diese Elemente ohne einen Partner alleine stehen
H2O ist es wieder das gleiche. Wasserstoff steht in der ersten Hauptgruppe also +I und Sauerstoff steht glaube in der 6. Hauptgruppe und bekommt -II.
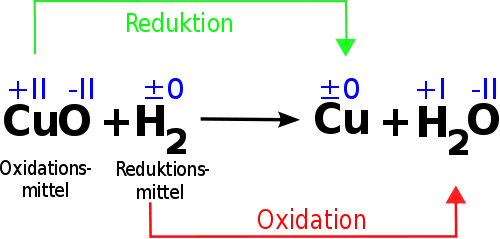

Nun, der Reaktionspartner, der oxidiert wird, gibt Elektronen ab, der Reaktionspartner, der reduziert wird, nimmt Elektronen auf.


Weißt du wie man Oxidationszahlen bestimmt?
und woran erkenne ich wer sie abgibt und wer Elektronen aufnimmt?😊