Wie soll das bitte gehen Hilfe?
Stellen die Neutralisationsgleichung
von Phosphorsäurelösung (H3PO4 - Lösung) mit Natronlauge ( NaOH- Lösung) auf ( nur vollständige Dissoziation).
Trage alle korrespondierenden Säure-Base- paare ein und benenne das entstehende Salz.
Ich habe versucht anzufangen, aber komme nicht weiter mit den Verhältnissen. Kann das jemand von euch ?
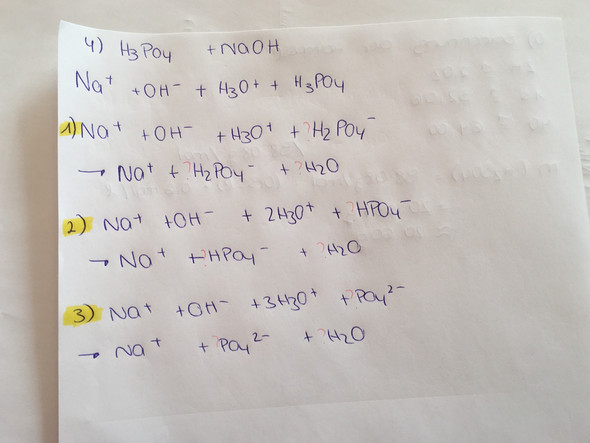
2 Antworten

Erster Schritt: H3PO4 + NaOH <==> H2PO4− + Na⁺ + H2O
Zweiter Schritt: H2PO4− + NaOH <==> HPO42− + Na⁺ + H2O
Dritter Schritt: HPO42− + NaOH <==> PO3− + Na⁺ + H2O
Man kann natürlich auch alternativ das NaOH auf der linken Seite als Ionenschreibweise darstellen: NaOH(aq) = Na⁺ und OH⁻ Das "(aq)" steht für aqueous und heißt soviel wie "in Wasser gelöst", als auch in Ionen vorliegend.
Man sieht anhand der so dargestellten Reaktionsgleichungen, dass bei jedem Schritt ein saures Proton mit einem OH⁻ aus der Natronlauge zu Wasser reagiert (Neutralisation).


Das was du beim NaOH richtig gemacht hast hast du beim H3PO4 falsch gemacht du musst zuerst die beiden Stoffe trennen damit Na+ + OH- + PO3 - + H3O+ da steht und dann so auflösen das du 2H2O erhältst

oh ok und wie genau muss ich das aufschreiben, mit allen 3 Dissoziationsstufen ?

Ok ich weiß nicht was die Dissoziazistionsstufen sind aber die Neutralisation sollte so richtig sein
Vielen Dank, unser Lehrer möchte immer dass wir auch immer H30+ hinschreiben und Na und OH trennen , weil es eine Lösung ist, aber ich weiß nicht welche Gleichung dabei rauskommt und den Verhältnissen