Wie kann man hier anhand der Edelheit der Metalle erkennen, ob überhaupt eine Reaktion passiert?

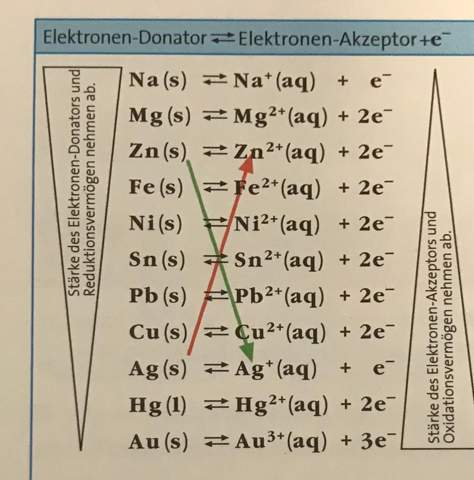
Man kann bei der Aufgabe bspw. bei c) Ni(s) und Pb2+ sehen. Wenn man in die Tabelle schaut, sieht man dass sie sich ausgleichen. (Ni(s) ist das 5. Metall von oben links und Pb2+ das 5. Metall von unten links.
Aber was bedeutet das? Ich verstehe nicht, wieso die Reaktion hier nicht verläuft? Gleicht da was aus? Aber was denn?
Danke an jede Hilfe!
2 Antworten

Die sachliche Erklärung hat MeisterRuelps schon geliefert.
Jetzt kommt die Anleitung:
Du verbindest die beiden Edukte mit einem Pfeil - vom festen Metall zum => Ion.
Also so: Beispiel c): Ni(s) => Pb(2+)
Wenn dieser Pfeil nach rechts unten zeigt, ist er grün und die Reaktion läuft ab.
Wenn dieser Pfeil nach rechts oben zeigt, ist er rot und die Reaktion läuft nicht ab.
Damit hast du vielleicht nicht die Theorie verstanden, aber erhältst mit Sicherheit die richtige Lösung. Theorie steht bei MeisterRuelps.
LG


Das weniger edlere Element, wird niemals ein Element, das edler ist, Elektronen entziehen, also dieses oxidieren können, da das Potenzial zu gering ist.
Umgekehrt passiert dies jedoch: Ein Stab aus Zink in eine Silbernitratlösung getaucht wird dazu führen, dass sich Silber am Stab abscheidet und dafür Zink in Lösung geht. Umgekehrt wird das aber nicht passieren


Ahhh okay dankeschön. Also also z.B. bei c) passiert keine Reaktion, weil Ni(s) unedler ist als Pb2+(aq), richtig?