Wie geht das mit der Neutralisation?
Kann mir jemand erklären, wieso was passiert auf dem Anhang? Und was passiert, wenn eine schwache Säure mit einer schwachen Base reagiert? Das Gleiche, wie wenn beide stark sind?
1 Antwort

Prinzipiell geben (Brönsted-)Säuren Wasserstoffionen ab, (Brönsted-)Basen nehmen Wasserstoffionen auf.
In reinem Wasser liegt H₂O vor und durch die sogenannte Autoprotolyse des Wassers sehr wenig H₃O⁺ (Wasser + Wasserstoffion) und ⁻OH.
Gibt man eine Base in Wasser, nimmt sie H⁺ von den H₃O⁺-Teilchen auf und entreißt auch H₂O Wasserstoffionen, so dass die Konzentration an ⁻ÖH steigt. Das nennt man dann basisch. Die typischen starken Basen sind Teilchen, die direkt ⁻OH abgeben, z.B. NaOH, KOH, Ca(OH)₂ etc.; die eigentliche Base ist also das ⁻OH-Teilchen. Es bleibt aber auch ein Basenkation zurück, z.B. Na⁺, K⁺ etc.
Gibt man Säuren in Wasser, gegen sie H⁺ ans Wasser ab (und an die paar ⁻OH, die rumschwimmen. Das nennt man dann sauer. Hier bleibt aber auch ein Säureanion zurück, z.B. Cl⁻ bei HCl, SO₄²⁻ bei H₂SO₄ etc.
Gibt man Säuren und Basen zusammen, so geben die Säuren also einerseits H⁺ ab, andererseits nehmen die Basen H⁺ auf. Aus H⁺ und ⁻OH wird also Wasser. Basenkation und Säureanion bilden ein Salz.
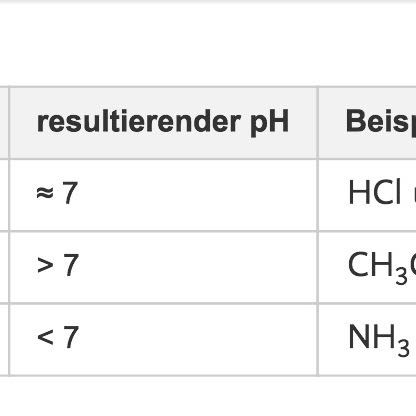
Wenn eine Säure stark ist, dann gibt sie sehr bereitwillig ihre Protonen ab. Dementsprechend kann das Säureanion keine gute Base sein (sonst würde es das Wasserstoffion ja gar nicht erst abgeben). Genauso, nur mit umgekehrten Vorzeichen ist es bei Basen. Daher neutralisieren sich starke Säuren und starke Basen im eigentlichen Sinne. Die zurückbleibenden Säure- und Basenreste sind selbst neutral, also ist die entstehnende Lösung neutral
Wenn die Säure schwach ist, hat sie ihr Wasserstoffion recht gerne bei sich, gibt aber auch ein paar ab. Wenn man jetzt durch eine starke Base der schwachen Säure alle Wasserstoffionen wegnimmt, dann bleibt ein Säureanion zurück, das eigentlich recht gerne auch wieder Wasserstoffionen anlagert - und das auch tut. Daher sind "neutralisierte" schwache Säuren in Lösung immer etwas basische.
Für Basen gilt wieder das gleiche mit umgekehrten Vorzeichen.
