Wie bestimme ich die Masse eines Stoffes an diesem Beispiel (Chemie)?
gegeben: HCl reagiert mit 0,5000g Al(OH)3
Gleichung lautet: AL(OH)3 + HCl -> AlCl3+ 3H20
gesucht: Masse an HCl
2 Antworten

Als erstes benötigst du, wie du schon richtig notiert hast, die Reaktionsgleichung:
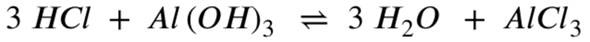
Mit der Molaren Masse von Aluminiumhydroxid kannst du ausrechnen, wie viel mol 0,5 Gramm Aluminiumhydroxid entsprechen:
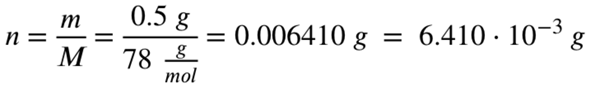
Jetzt weißt du, wie viel mol Aluminiumhydroxid du vorliegen hast.
Aus der Reaktionsgleichung kannst du entnehmen, dass du mit 1 Aluminiumhydroxid 3 HCl zur Reaktion bringen kannst, die Verhältnisse sind hier als 1:3. Für die Stoffmenge an HCl heißt das konkret:
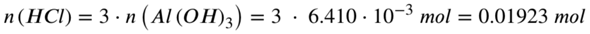
Mit der Molaren Masse von HCl kannst du abschließend ausrechnen, wie viel Gramm diese 0,01923 mol HCl entsprechen:
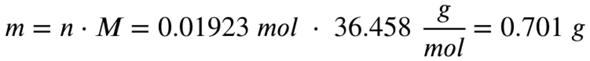
Um 0,5 Gramm Aluminiumhydroxid zur Reaktion zu bringen, benötigst du also 0,701 Gramm HCl.
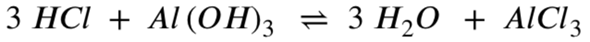
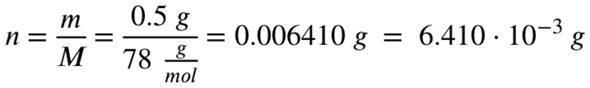
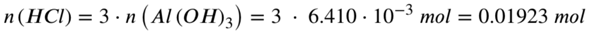
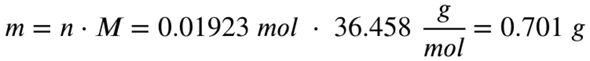

Dazu benötigst du die molare Masse. Die findest du z.B. auf Wikipedia oder rechnest sie selber aus über die Atommasse.
Al - 27
O - 16
H - 1
Cl - 35,45
Die molare Masse von Al(OH)3 beträgt folglich 27 + 3 * (16+1) = 78 g/mol
Die Masse von HCL ist 1 + 35,45 = 36,45 g/mol
Jetzt kannst du den Dreisatz anwenden. 0,5 g / 78 * 36,45 = 0,2337 g



Hast recht. Ich hab übersehen, dass es 3 HCL sind und nicht nur eins.
Habe es jetzt verstanden, danke!