Titrationskurve Pufferbereich?
Hallo ich bräuchte eure Hilfe bei einer Aufgabe in Chemie. Ich habe eine Titration durchgeführt, mit NaOH (1M) als Maßlösung und Essigsäure (0,1M) 100ml als Probelösung. Nun entsteht in Bereich des Halbäquivalenzpunktes (nach ca 3ml NaOH Zugabe)ein Essigsäure - Actetatpuffer, da de gleich viele mol Ac- wie HAc vorhanden sind. Der pH Wert einer Pufferlösung kann mit der Hendersson Haselbach Gleichung ermittelt werden. Nun ist meine Frage wie ich die Konzentration der Ac- und HAc Teilchen ermitteln kann?
Vielen Dank im Voraus
1 Antwort

Nun ja, Essigsäure ist recht schwach, d.h. nur wenige Essigsäuremoleküle reagieren mit Wasser zu H₃O⁺. In einer 0.1 mol/l Lösung liegen 98.7% als CH₃COOH vor und nur 1.3% als Acetat. Das ist Deine Situation bei 0 ml Verbrauch.
Umgekehrt ist Acetat wirklich eine ausgesprochen schwache Base. In einer 0.1 mol/l Lösung liegen 99.99% davon als Acetat vor, die freien Essigsäuremoleküle kannst Du Dir an einer Hand abzählen. Das ist Deine Situation bei 10 ml Verbrauch (durch das Volummen der Maßlösung hat Du aber eine Konzentration von nicht 1⁄10 sondern 1⁄11 mol/l)
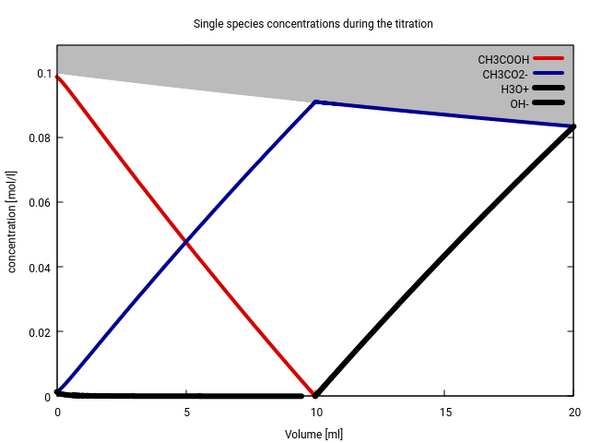
Also kannst Du in sehr guter Näherung die Konzentration folgendermaßen bestimmen: Bei Volumen Null ist c(Essig)=0.1 und c(Acetat)=0, bei irgendeinem Volumen 0<v<10 ist c(Acetat)=(10−v)/(100+v) und c(Essig) um diesen Betrag vermindert. So sieht das dann aus (rot die Säure, blau das Anion):
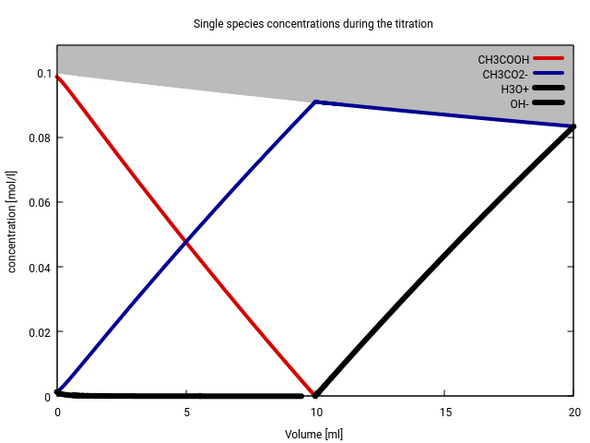
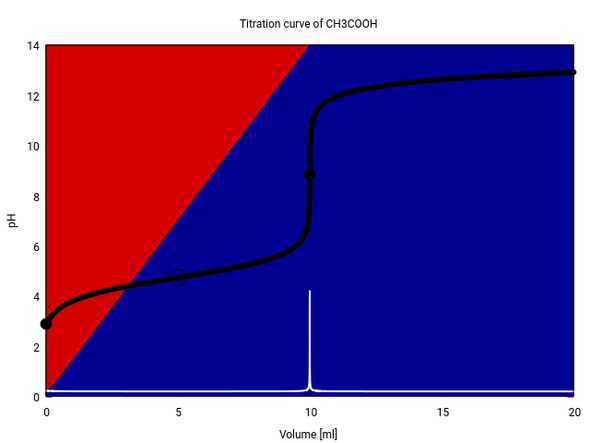
Das ist ein bißchen kompliziert, weil sich das Volumen dauernd ändert und daher die Summe von Essig und Acetat nicht konstant bleibt (vgl. graue Fläche am oberen Rand). Etwas einfacher kann man fast dieselbe Infomation zeigen, indem man aufzeichnet, wie sich da Verhältnis von Essig:Acetat im Lauf der Titration ändert. Die folgede Graphik zeigt das: Zusätzlich zur bekannten Titrationskurve (schwarz) sind auch noch die relativen Anteile Essigsäure (rot) und Acetat (blau) eingetragen.
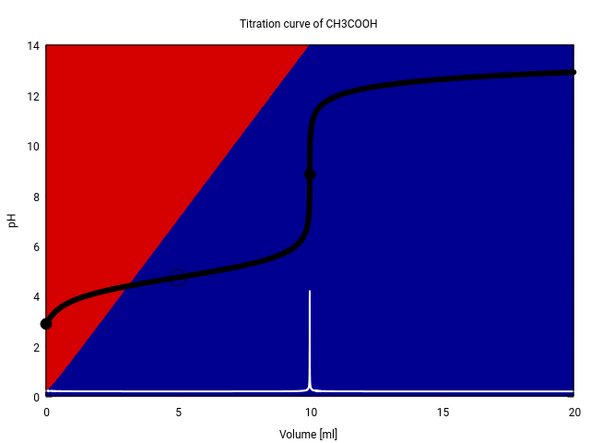
Da die Hintergrundfarben in dem Plot echt berechnet wurden (und nicht der oben angegebenen Formel geschätzt), kannst Du auch erkennen, daß bei Verbrauch Null die Säure nicht exakt 100% ausmacht, sondern nur die oben erwähnten 99.7%.