Teilchen nach Konzentration ordnen?
Hallo, kann mir bitte jemand erklären wie das geht?

Also a) haben wir im Unterricht gemacht und den Rest verstehe ich nichzt
a) c(H2O)> c(H3O+)>c(Cl-)> OH-
kann mir das bitte jemand erklären und für b) machen..bitte einfach erklären

Das habe ich bisher
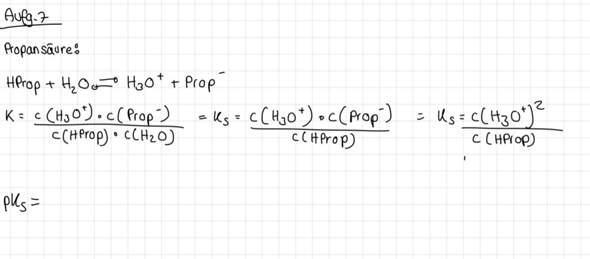
2 Antworten

C)
Das Natriumhydroxid dissoziiert in wässriger Lösung wie folgt:
NaOH <--> Na+ + OH-
Dementsprechend formuliert sich das MWG:
Kc = [Na+] * [OH-] / [NaOH]
Es liegen nun wie man sieht Natriumionen, Hydroxidionen und ein seeehr geringer Anteil an nicht dissoziiertem Natriumhydroxid vor. Dazu natürlich noch das Wasser.
Nach Konzentrationen geordnet ist die Reihenfolge:
Wasser > Na+ = OH- >> NaOH >> H3O+ (H3O+ kann man weglassen bei dieser vernachlässigbar geringen c, aber da du es im Beispiel auch mit beiden Ionen schreibst, hab ich das auch so gemacht)

b: CH3COOH + H2O <-- --> CH3COO^- + H3O^+
K(c) = [CH3COO^-] * [H3O^+] / ( [CH3COOH] * [H2O]
CH3COOH: Ethansäure
CH3COO^- : Acetatanion
H2O: Wasser
H3O^+: Oxoniumion
c(H2O) > c(CH3COOH) > c(H3O^+) =(ungefähr) (CH3COOH^-) > c(OH^-)

Die Lösung ist wässrig, also besteht sie zum Großteil aus Wasser. Essigsäure ist eine schwache Säure, also liegt sie in der Regel eher als Molekül vor, nur in niedrigen Konzentrationen liegt sie ionisch vor (oswaldsches Verdünnungsgesetz) ich habe allerdings aus Faulheit nicht den Dissoziationsgrad für 0,1molare Essiglösungen ausgerechnet. Die Konzentration von Oxoniumionen ist bedingt durch die Autoprotolyse des Wassers und den Essigsäureumsatz, also (c(Ac^-) + 10^-7) mol/l also immer größer als die Säureanionenkonzentration, aber immer ungefähr gleich. Da es sich um die Reaktion einer Säure mit Wasser handelt liegt OH^- in geringer Konzentration, bedingt durch die Autoprotolyse des Wassers vor c(OH^-) = 10^-7 mol/l-

Okey danke …findest du dazu ein YouTube Video was es das nochmal erklärt 😬damit ich es besser verstehe


Danke könntest du vllt nur diese Ordnung auch für c und d machen?🙏🏻

Deine Hausaufgaben musst du schon selber machen. ^^ Hab Vertrauen in dich.


Doch, das Video erklärt das, nur impliziert das Video die Antwort, sie wird nicht explizit erwähnt.


Könntest du das bitte noch für c und d machen?😣

Bitte ich habe es versucht aber ist eh falsch 😣

d: NH3 + H2O <-- --> NH4^+ + OH^-
K(c) = [NH4^+] * [OH^-] / ( [NH3] * [H2O]
NH3: Ammoniak
NH4^+: Ammoniumion
H2O: Wasser
OH^-: Hydroxidion
c(H2O) > c(NH3) > c(OH^-) =(ungefähr) (NH4^+) > c(H3O^+)
c machst du alleine.

Das Video erklärt es gar nicht😣ich brauche gute Erklärungen dazu😣

Okay, dann so.
1: Alle diese Reaktionen finden in Wasser statt. Das heißt du hast immer vor allem Wasser vorliegen. Beispiel: NaOH 0,1mol/L:
Die Konzentration der Natronlauge liegt bei 0,1mol/L.
Die Konzentration des Wassers liegt bei etwa: 1000g/( 18g/mol * 1L) = 56mol/L, ist also etwa 560 mal so groß wie die NaOH-Ausgangskonzentration.
2: Starke Säuren/Basen reagieren fast vollständig. NaOH ist eine sehr starke Base, die Ausgangskonzentration von 0,1mol/L wird also fast vollständig zu OH^- und Na^+ umgesetzt. In der Lösung selbst befindet sich also nur noch seeeeehr wenig Natornlauge, dafür etwa 0,1mol/L Na^+ und 0,1mol/L OH^-.
Dazu kommt jetzt noch die Autoprotolyse des Wassers, mit 10^-7 mol/L OH^- und 10^-7 mol/L H3O^+. Das heißt. c(Na^+) = 0,1mol/L und c(OH^-) = 0,1mol/L + 10^-7mol/L = 0,1000001mol/L.
Wir haben also End-Konzentrationen von:
NaOH = ungefähr 0mol/L
H3O^+ = 10^-7mol/L
Na^+ = 0,1mol/L
OH^- = 0,1000001mol/L
daraus folgt: c(NaOH) < c(H3O^+) << c(Na^+) < c(OH^-)


Aber vorher hast du was anderes zu b) geschrieben😬

Essigsäure ist eine schwache Säure. Schwache Säuren liegen eher molekular als ionisch vor, da nur ein kleiner Teil der Essigteilchen dissoziiert. Hier gilt das oswaldsche Verdünnungsgesetz: Der Dissoziationsgrad steigt mit sinkender Konzentration.
Der pKs-Wert von Essig liegt bei 4,76.
Gemäß der pH-Gleichung für schwache Säuren liegt die Endkonzentration von H3O^+ also bei: pH = 1/2(pKs - lg(HA)) = 1/2(4,76 + 1) = 2,88
c(H3O^+) ist dementsprechend = 10^-pH = 10^-2,88 mol/L = 0,00132 mol/L
Wie du sehen kannst ist 0,00132mol/L sehr viel kleiner als 0,1mol/L
c(HAc) = 0,1mol/L - 0,00132mol/L = 0,0987mol/L
Die Konzentration der Säureanionen ist bei einprotonigen Säuren notwendiger Weise gleich der H3O^+ Konzentration da aus der Reaktion eines Säureteilchens ein H3O^+ und ein A^- Teilchen hervorgehen.
Die Hydroxidionenkonzentration ist sehr klein, da pOH = 14-pH = 14-2,88 = 11,12
--> c(OH^-) = 10^-11,12mol/L = 7,586*10^-12 mol/L bzw. 0,000000000007586mol/L.
danke aber warum hast du das so geordnet? Könntest du es mir bitte erklären?