Standardreduktionspotential ohne Tabelle berechnen?
Guten Abend
ich stehe bei folgende(n) Aufgaben an:
Für die folgende Reaktion:
Cd2+ (aq) + Fe (s) = Cd (s) + Fe2+
wurde bei 298 K eine Gleichgewichtskonstante von K=20 gemessen.
a) Berechnen Sie das Standardreduktionspotential für die Cadmium-Elektrode (Cd2+/Cd) wenn E0 (Fe2+\Fe) = -0.44 V (Rechenweg erforderlich)
b) Angenommen die Startkonzentrationen von Fe2+ und Cd2+ seien 1M, berechnen Sie die Gleichgewichtskonzentrationen von Fe2+ und Cd2+.
Danke im Vorraus!
1 Antwort

Cd²⁺ + Fe ⟶ Cd + Fe²⁺ K=20
Wenn man nun weiß, daß ΔG=−RTln(K) und ΔG=−zFΔE, dann kommt man sofort auf ΔE=RT/(zF) ln(K) = +0.04 V. Das wäre also die Standard-Zellspannung für ein Fe/Cd-Element, und dieselbe kriegt man natürlich auch als Differenz der Standardreduktionspotentiale von Cd und Fe:
ΔE = ε(Cd²⁺/Cd) − ε(Fe²⁺/Fe) ⟹ ε(Cd²⁺/Cd) = ΔE − ε(Fe²⁺/Fe) = −0.40 V
Der zweite Teil ist auch nicht schwierig. Wir wissen ja die Gleichgewichtskonstante der Reaktion K=20, und ins Massenwirkungsgesetz gehen nur die Ionenkonzentrationen ein. Wir setzen jedes Ion mit c₀=1 mol/l an, und die Reaktion produziert für jedes verbrauchte Cd²⁺ ein neues Fe²⁺. Daher:
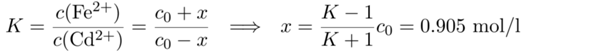
Wir bekommen also c(Fe²⁺)=c₀+x=1.9 mol/l und c(Cd²⁺)=c₀−x=0.1 mol/l.

Super! Danke dir, schlüssig und macht absoult sinn. Hatte mich etwas verrannt und denn Fokus verloren 🫠😂