Redoxreaktion für Dampfreformierung?
Hallo Leute,
eigentlich ist das Prinzip von Redoxreaktionen mir sehr bekannt, doch bei dieser Frage wird es für mich knifflig:
Stelle eine Redoxreaktion für die Dampfreformierung auf, bei der aus Methan und Wasserdampf, Kohlenstoffmonoxid und Wasserstoff entsteht.
Die Reaktionsgleichung ist angegeben mit:
CH4 + H20 --> CO + 3H2
Ich habe alle möglichen Quellen durchforstet und es bereits mit Oxidationszahlen versucht, obwohl wir diese noch nicht besprochen haben.. Doch ich komme nur darauf, dass CH4 --> CO + 4e irgendwie zur Oxidation und H2O + 2e --> 3H2 + O^2- zur Reduktion gehört, was aber überhaupt keinen Sinn ergibt (v.a. bei der Oxidation)
Bitte wirklich dringend um Hilfe!!
1 Antwort

CH₄ + H₂O ⟶ CO + 3 H₂
Die Oxidationszahlen verraten es: Der Kohlenstoff wird vom C⁻ᴵⱽH₄ zum C⁺ᴵᴵO oxidiert (−IV → +II, gibt also 6 Elektronen ab), und jedes Wasserstoffatom (sowohl im CH₄ als auch im H₂O) nimmt ein Elektron auf (+I → 0); der Sauerstoff hat links und rechts immer −II, tut also redoxmäßig gar nichts. Da insgesamt 6 H-Atome da sind, geht die Rechnung glatt auf.
Handschriftlich hingekritzelte Ergänzung: Leider wollte der Kugelschreiber nicht so, wie ich wollte, aber ich hoffe, es ist trotzdem lesbar.
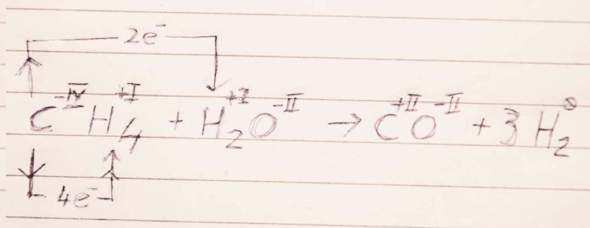
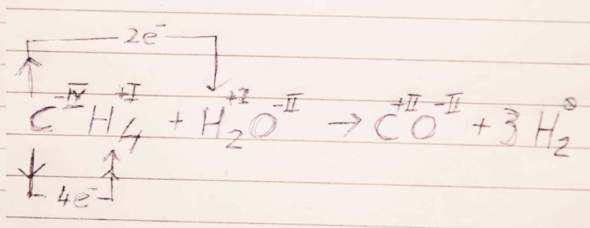

Ich würde die Reduktion einfach aufschreiben als
6 H⁺ᴵ + 6 e⁻ ⟶ 3 H₂
Wobei der Wasserstoff mit Oxidationszahl +I links aus zwei verschiedenen Molekülen kommt, was zugegebenermaßen ein bißchen unüblich ist.
Die Oxidation kannst Du natürlich ebenso aufschreiben:
C⁻ᴵⱽ ⟶ C⁺ᴵᴵ + 6 e⁻
Das ist in diesem Fall so ziemlich die beste Schreibweise, die mir einfällt, obwohl sie zugegebenermaßen nicht wirklich gut ist. Ich habe eine Idee, wie man das graphisch besser hinkriegen kann, und werde die Antwort in ein paar Minuten um ein Bild mit handschriftlicher Kritzelei ergänzen.

Nochmals danke für die Aufklärung! Hast meinen Tag wirklich gerettet

Nach ein paar Krämpfen mit der Tücke des Lebens ist das Gekritzel online.
Danke für deine Antwort! Doch wie kann ich das Geschehene aufschreiben? Also bei der Oxidation dann CH4 --> CO + 6e und bei der Reduktion H2O + 2e--> H2 + O^2-?
Denn wenn ich versuche, es so aufzuschreiben, macht es keinen Sinn.. Anders wie wir es sonst hatten mit Al--> Al^3+ + 3e