Redoxreaktion aufstellen anhand Bsp.?
Was sind die teilgleichungen zu dieser redoxreaktion
Die Reaktion findet im alkalischen statt
ich geh davon aus das H2PO2 die Oxidation ist und MnO4- die Reduktion
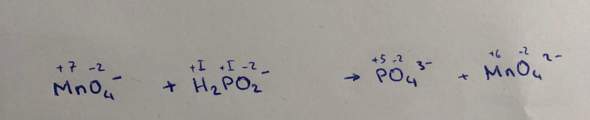
2 Antworten


Erst einmal schaust du dir die Oxidationsstufen an. Hierbei geht es vermutlich um Mangan und Phosphor. Die Oxidationsstufe von Mangan fällt von 7 auf 6. Mangan nimmt ein Elektron auf und wird reduziert.
Hingegen gibt der Phosphor 4 Elektronen ab. Er wird oxidiert.
Jetzt musst du die Ladungsbilanz korrigieren. Im alkalischen Milieu macht man das mit Hydroxidionen.
Anschließend wird noch die Stoffbilanz mit Wasser ausgeglichen.
Du siehst: Bei der Reduktion wird ein Elektron aufgenommen. Bei der Oxidation werden 4 Elektronen abgegeben. Du musst nun eine der beiden Gleichungen mit einem Faktor multiplizieren, das die Zahl der Elektronen in beiden Gleichungen identisch ist. D.h. alle Vorfaktoren der Reduktion vervierfachen.
Jetzt schreibst du alle Edukte auf eine gemeinsame Seite und alle Produkte auf eine gemeinsame Seite:
Nun die Elektronen kürzen und fertig.