Oktettregel bei Schwefelsäure nicht erfüllt?
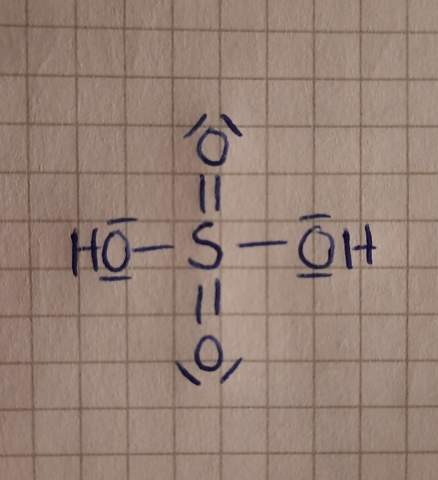
S besitzt statt erstrebenswerten 8 Valenzelektronen, ganze 12!
Wenn das Thema komplexer ist, reicht es auch aus einen Begriff für ein solches Phänomen zu nennen. Dann kann ich selber nachlesen und mich schlau machen.
Danke :)
2 Antworten

Dass Schwefel hier eigentlich zu viele Bindungen hat, stimmt. Das Oktett ist für S aber formal trotzdem erfüllt. Schließlich verliert es alle seine Elektronen an die Sauerstoffatome und hat somit eine Oxidationsstufe von +6, was einer komplett leeren Außenschale entspricht.
Was hat das aber jetzt mit den vielen Bindungen auf sich? Naja, die Strukturformel stimmt so eigentlich nicht. Die bindungskonforme oder sagen wir, "richtigere" Zeichnung wäre die hier:
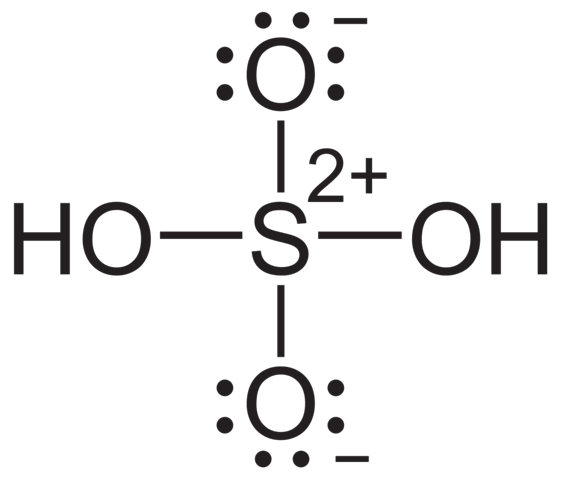
Danach hat Schwefel nicht mehr zu viele Bindungen und die Oktettüberschreitung verschwindet.
Das funktioniert bei Schwefelsäure, aber es gibt Moleküle wie SF6, bei denen geht das nicht durch eine andere Zeichnung. Das liegt daran, dass die Bindungssituation nicht so schwarz-weiß ist, wie man sie normalerweise zeichnet.
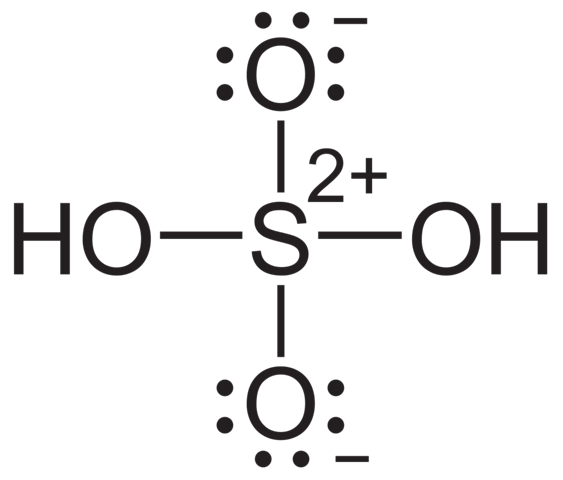

Im Prinzip hast du recht, dass Ladungen immer ungünstig sind und vermieden werden sollten. Allerdings kann das Atom nun mal nichts gegen seine Natur machen und mehr als 4 Bindungen wiedersprechen eben dieser. Hauptgruppenelemente wie Schwefel und Phosphor haben nur 4 Orbitale zur Verfügung. Mehr als vier kovalente Bindungen sind daher schlicht und ergreifend nicht möglich.
(Früher dachte man übrigens, dass die Beteiligung von d-Orbitalen die Erklärung für diese Oktettüberschreitung ist. Das hat sich als falsch herausgestellt, wird aber immer noch öfter von Lehrbüchern und Websiten behauptet)
Die Oktettüberschreitung kommt daher, dass man hier formale Mehrzentrenbindungen hat bzw zeichnen müsste. Das geht aber nicht, da die Lewis-Formeln das nicht hergeben. Daher macht man das so mit diesen Ladungen. In Realität haben diese Bindungen auch einen nicht zu vernachlässigenden ionischen Charakter. Von daher repräsentiert so eine Zeichnung die reale Bindungssituation tatsächlich besser als die mit den Doppelbindungen.

Also davon verstehe ich, dass Sie nicht gegen den Konzept vom erweiterten Oktett stehen, sondern meinen, dass es erst stattfindet, wenn wir bei der dritten Periode sind ?
Ansonsten wie könnten wir ohne die Oktetterweiterung die Bindungen einiger Moleküle wie ICl2- erklären ?

Die Oktettregel gilt streng nur für Elemente der 2. Periode ja. Ab der dritten sind dann auch Oktettüberschreitungen möglich. Die Oktetterweiterung ist aber keine wirkliche Erklärung für diese Phänomene. Sie sagt nur, dass die Oktettregel ab der dritten Periode nicht mehr streng gilt und damit Verbindungen wie SO4^2- oder eben auch ICl2^- möglich sind. Warum genau das geht, kann die Erweiterung aber nicht erklären.
Dafür braucht es dann die MO-Theorie. Damit ist eine Erklärung möglich. Denn Bindungen sind eben nicht immer nur kovalent oder ionisch. Es gibt auch Bindungen, die dazwischen liegen (also halb kovalent, halb ionisch, zum Beispiel). Oder auch Bindungen, die sich über mehr als zwei Atome erstrecken (Beispiel: 3-Zentren-2-Elektronen-Bindung).
Das Problem bei diesen ganzen "Ausnahme-Bindungen" ist, dass man sie schlecht zeichnen kann. Das heißt, dass die Lewis-Formel, die man zeichnet, meistens nicht die korrekte Bindungssituation wiedergibt. Beispiel: Die B-H-B Bindung. In der Zeichnung sieht das jetzt so aus, als hätte das H zwei Bindungen und damit 4 Elektronen um sich herum. Das widerspräche ja beides den gängigen Regeln zur Bindungsbildung. Tatsächlich ist sind das aber gar nicht zwei Bindungen, sondern nur eine, die sich über alle drei Atome erstreckt. Diese enthält auch nur 2 Elektronen (das ist die oben angesprochene 3-Zentren-2-Elektronenbindung). Nur zeichnen kann man das halt schlecht.
Das ist was ich meinte mit "die Lewis-Formeln geben das nicht her". Bei SO4^2- ist das ein ähnliches Problem was das Zeichnen angeht.

Das Phänomen heißt „erweitertes Oktett“ — das können die Nichtmetalle ab der dritten Periode, z.B. PF₅, H₂SO₄, H₅IO₆, XeO₄ mit 10, 12, 14 bzw. 16 Elektronen.

Ich dachte, dass es besser ist, die Formalladung der beteiligten Atome auszugleichen, wie es hier steht : http://www.uwosh.edu/faculty_staff/gutow/Lewis_Tutorial/PO4_8.html