

Die vDW Kräfte sind umso höher, he besser sich die Ketten aneinander lagern können. Der Knick stört da. Stells dir vor wie zwei Rohre. Zwei gerade Rohre kannst du besser aneinander anlegen als ein gerades und eins mit Knick.


Die vDW Kräfte sind umso höher, he besser sich die Ketten aneinander lagern können. Der Knick stört da. Stells dir vor wie zwei Rohre. Zwei gerade Rohre kannst du besser aneinander anlegen als ein gerades und eins mit Knick.


Würde behaupten, das kommt auf die Anwendung an. Also erstmal neutralisieren sich Natron und Säuren. Die vorher zu mischen ist sinnfrei. Nacheinander anzuwenden kann was bringen.
Zitronensäure ist in manchen Anwendungen deswegen besser, weil es Metallionen (wie z.b. das Calcium beim Entkalken) komplexieren kann anstatt es einfach nur in andere einfache Salze umzusetzen wie Salzsäure das z.b. macht. Letztere ist außerdem deutlich aggressiver und kann u. U. auch das Material angreifen, das man eigentlich reinigen will (die Keramik einer Toilette juckt das zum Beispiel gar nicht, wenn da Salzsäure dran kommt, eine Kaffeemaschine würd ich damit aber eher nicht entkalken). Daher sollte man die Reiniger auf die Anwendung abstimmen.


Energien sind immer dann negativ, wenn sie frei gesetzt werden. Da CO2 ja entsteht, wird diese Energie frei. Umgekehrt musst du bei einem Edukt das reagiert die Bindungsenthalpie aufwenden, um das Molekül bzw. die Bindung zu zerstören. Daher ist sie positiv.
In einer Tabelle macht es nun aber keinen Sinn, negative Energie zu schreiben, weil der Tabellenersteller ja nicht weiß, ob die fragliche Bindung bei dir geknüpft oder gebrochen wird. Deswegen spart man sich das Minus.


Das H2O gibt das H+ ab, nicht das OH-. Aber ja, das Elektron vom Natrium kriegt das H+. Das wird dann zum Wasserstoffatom H und verbindet sich mit einem zweiten zum H2.
Das Natrium macht das selbstverständlich deswegen, weil es gern eine volle Schale hätte bzw. die Oktettregel erfüllen will.


HSO3 gibt es nicht, das ist HSO3^- und das kommt von der schwefligen Säure H2SO3.
Und ja, H3O+ ist immer positiv geladen, weil es ein H2O ist, das ein H+ aufgenommen hat.


Berechnen kann man die nicht so ohne weiteres, dafür brauchst du mehr Angaben. Ist auch unnötig, da man diese Werte für gewöhnlich in Tabellenwerken nachschlägt.


Dafür musst du zunächst schauen ob eine der beiden Komponenten in der ersten Reaktion im Überschuss vorliegt. Denn wenn die anfangs genau im Verhältnis der Reaktionsgleichung (also Zn:HCl 1:2) vorliegen, passiert beim verdoppeln eines Edukts logischerweise nichts. Die erhöhte Menge eines der beiden Edukte kann ja nur reagieren, wenn entsprechend viel vom anderen da ist.


Für gewöhnlich wird das aus Salicylsäure und Essigsäureanhydrid hergestellt. Sieht man auch in dem Wikipedia-Artikel von dem dein Bild stammt.
Also. Gedanklich spaltest du das Molekül am roten Strich.
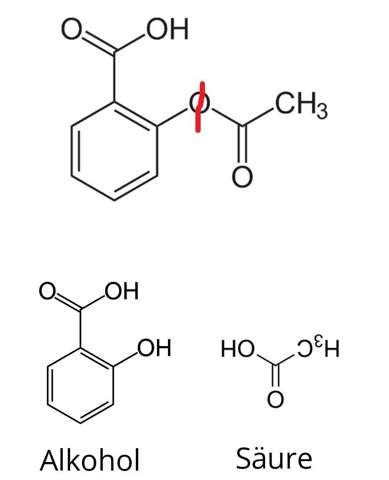
Dadurch erhälst du Säure und Alkohol. Die Essigsäure steht auf dem Kopf, damit man besser sieht, welcher Teil vom Molekül das war.
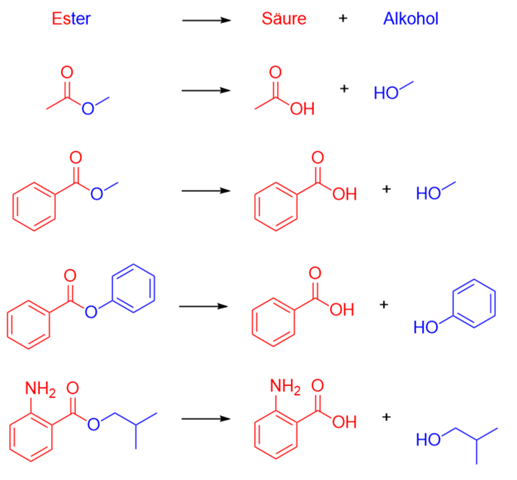
Kleine Übersicht mit Beispielen:


(mit TPE meinst du thermoplastische Elastomere oder?)
Bezweifle tatsächlich dass das direkt vom Kunststoff kommt. Die sind auch für den menschlichen Kontakt ziemlich ungefährlich, weil Polymere aufgrund ihrer riesigen Moleküle eine extrem schlechte Bioverfügbarkeit haben.
Diese Blasenbildung dürfte eher auf im Kunststoff enthaltene Weichmacher oder Lösungsmittel zurückzuführen sein, die mit der Zeit aus dem Kunststoff austreten. Das Latex reagiert auch nicht damit, wie man vielleicht vermuten würde, sondern quillt nur auf, daher diese Blasen. Diese Weichmacher und Lösungsmittel sind - im Gegensatz zu den Polymeren selbst - gesundheitlich nicht ganz so unbedenklich. Zumal man auch nicht mit Sicherheit sagen kann, was das genau ist.
Dass es sich um einen chinesischen Hersteller handelt, der auf aliexpress verkauft, spricht allerdings schon Bände über die Produktqualität. Ich würde die Finger davon lassen, besonders wenns keine EU-Zertifizierung für das Material gibt.


Die 8 kommt von den Elektronen, die dem O zugeordnet werden. Das sind je 2 aus 2 Bindungen (also 4) plus je 2 aus 2 freien Elektronenpaaren, die ein O besitzt (nochmal 4). Macht insgesamt 8.


Ist doch super einfach. Aluminium, dritte Hauptgruppe, gibt drei Elektronen ab, bildet also Al^3+ Ionen. Chlor, siebte, Hauptgruppe, nimmt 1 Elektron auf (8-7=1), bildet Cl^- Ionen. Jetzt kombinieren sodass die Ladungen sich ausgleichen. Dafür brauchst du 1 Al^3+ und 3 Cl^-, denn +3 + 3 * (-1) = 0. Also ist Aluminiumchlorid AlCl3.


Das ist Lithium-Cobaltdioxid bzw. dessen reduzierte Form. Der korrekte Name wäre hier also Lithium-Cobalt(III,IV)-oxid.


Es gibt bessere Definitionen, ja, aber die sind weitaus komplizierter und erfordern ein MO-Schema der fraglichen Verbindung. Das ist so ohne weiteres (meist) nicht möglich. Dementsprechend ist die Regel mit dem Elektronenzählen für "Allerweltsverbindungen" durchaus praktikabel.


VSEPR ist schon mal eine gute Voraussetzung. Also, BeF2 ist relativ simpel, Be hat zwei verfügbare Elektronen, die sind beide in den Be-F Bindungen. Dementsprechend gibt es kein freies Elektronenpaar, das ein zusätzliches Hybridorbital bräuchte. Wir haben also nur 2 Bindungspartner, brauchen also zwei Hybridorbitale, das wäre dann sp. Daraus resultiert dann auch eine lineare Anordnung.
BeF3- funktioniert analog. Das ist letztendlich nichts anderes als ein Molekül aus BeF2 und F-. Da das Be jetzt 3 Bindungspartner hat, braucht es auch 3 Hybridorbitale, also sp2.
Analog BeF4^2-. Vier Bindungspartner, vier Hybridorbitale, sp3.
AsF5. Ab jetzt wirds schwieriger. Denn jetzt haben wir auf einmal mehr Bindungspartner als verfügbare Orbitale. Wie funktioniert das also? Das geht über Mehrzentrenbindungen und das kann man sich nicht so einfach herleiten. 5 Bindungspartner sind gemäß VSEPR in einer trigonalen Bipyramide angeordnet. Jetzt muss man schauen, wie da die möglichen Hybridorbitale passen könnten. Damit kommt man auf sp2, weil die drei sp2 Hybridorbitale in einem planaren Dreieck angeordnet sind. Das verbleibende p-Orbital steht nun nach oben und unten heraus und bindet beide verbleibenden F-Atome (quasi "abwechselnd" über Mesomerie).
Zum IF6+. Hier kann man keine wirkliche Hybridisierung mehr festlegen. In einer oktaedrischen Anordnung (was IF6+ ja hat) ist für die p-Orbitale keine Hybridisierung nötig, da die Orbitale ja von vornherein schon richtig ausgerichtet sind. Das s-Orbital nimmt aber auch an den Bindungen teil, es muss also eine Art Hybridisierung geben. Das ganze löst man über quantenchemische Rechnungen mit Mehrzentrenbindungen, also eine Art Mesomerie bzw. "Hin- und Her-Schwingung" zwischen Hybridisierungen. Das geht alles über die simple Hybridorbitaltheorie hinaus. Genauso wie bei analogen Verbindungen wie SF6 oder auch IF7.
Bildliche Darstellungen zu den Beschreibungen, siehe hier. Schau auch unbedingt die hypervalenzen Verbindungen an, das machts vielleicht deutlicher.


Das ist ein griechischer Buchstabe namens Eta. Wird für verschiedene Dinge verwendet wie Haptizität bei Komplexberbindungen oder Viskosität. Im Zusammenhang mit Energie ist aber der Wirkungsgrad am wahrscheinlichsten.


Das Methyl im Namen kommt von der Methylgruppe am O der Estergruppe. Würde da ein Ethylrest dran hängen, hieße es entsprechend Propansäureethylester.
Die Position im Namen kommt immer von der Struktur. Die Grundstruktur hier ist Propansäure. Da an der Säuregruppe aber statt dem H ein Kohlenstoffrest hängt, ist es ein Ester. Um das zu kemnzeichnen, wird der Name des Rests am Ende angefügt, gefolgt von "ester". Dementsprechend wird ein Propansäure-Molekül, an dessen Säuregruppe ein Methylrest ist, dann Propansäuremethylester genannt.


Damit dürften Halogenide gemeint sein, die Lewis-Säuren sind. Also zu wenig Bindungspartner haben, sozusagen. Klassisches Beispiel wäre da Bor. Das hat vier Orbitale zur Verfügung um theoretisch vier Bindungen auszubilden, aber es hat nur drei Elektronen. Dementsprechend kann es nur drei Bindungen bilden. Für eine vierte muss der Bindungspartner dann beide Elektronen mitbringen. Die Borhalogenide (z.b. BCl3) sind deswegen gute Lewis-Säuren.
Funktioniert auch analog mit Aluminium (z.b. AlCl3) oder Beryllium (BeCl2).


Zu 1. Das ist richtig. Um Einfachbindungen kann man drehen. In so einer Darstellung wie oben (Fischer-Projektion) darfst du das aber nicht machen! Diese Projektion stellt die Moleküle nämlich flach da, was in der Realität aber nicht der Fall ist.
Zu 2. Das liegt an der Projektion, wie oben erwähnt. Ich versuch das mal darzustellen. In der Fischerprojektion zeigen Bindungen, die links und rechts von der Hauptkette liegen, nach vorne aus der Ebene heraus. Das ist hier durch die dicken Keile markiert:
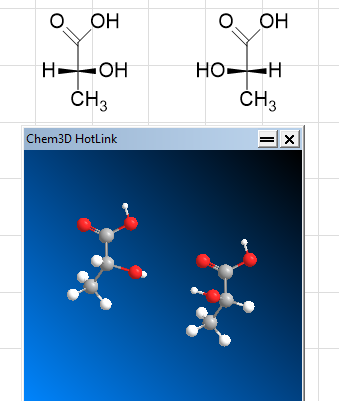
Drehst du jetzt um die H-C-OH Bindung kommt das Molekül rechts heraus. Wie man unten in der 3D-Darstellung sieht, ist das aber nicht mehr dasselbe Molekül, weil OH und H jetzt vertauscht sind. Das ist das was im Namen dann durch D und L markiert ist und deswegen darfst du in der Fischerprojektion nicht drehen.


Auf die Intensität kannst du bei Massenspektroskopie normalerweise nicht so viel geben. Je nach Spektrometer ist das keine akkurate Repräsentation der wirklichen Verhältnisse der einzelnen ionischen Spezies. Die ist nämlich abhängig vom Spektrometer bzw Detektor selbst und von den Molekülen bzw. dem Mechanismus mit dem sie ionisiert werden.


Du hast links 3 Gasteilchen, rechts nur 1. Der Zusatz ΔnRT in der Gleichung ist die Volumen- bzw. Druckarbeit (denn pV = nRT). Dabei fällt das H2O raus, denn das ist kein Gas und kann bei Betrachtungen von Volumen und Druck vernachlässigt werden.