Molekülschwingung, wie interpretiert man die Wellenzahl?
Angenommen ich habe mein Wasserstoff Molekül H2 und gegeben ist mir eine Molekülschwingung von 2000 cm^-1 was soll das überhaupt bedeuten?
Die Wellenzahl ist normalerweise ja der reziproke Wert der Wellenlänge für Licht. Durch die Beziehung λv = c und E = hv lässt sich so ganz leicht bestimmen das E = h*c*(Wellenzahl in m^-1). Also ist die Wellenzahl für Photonen einfach eine einheit der Energie.
Doch wie sieht das bei Molekülschwingungen aus? Die sind auch immer in cm^-1 angegeben was für mich wenig Sinn ergibt, denn dieses Schwingung propagiert ja nicht wie EM-Wellen durch den Raum so dass man sagen könnte das Wasserstoffmolekül schwingt 2000 mal pro cm. Hier ergibt für mich tatsächlich bloß die Frequenz als 1/s Sinn.
Da Frage ich mich auch direkt, wofür denn nun v in der Formel für erlaubte vibrations Energieniveaus steht:
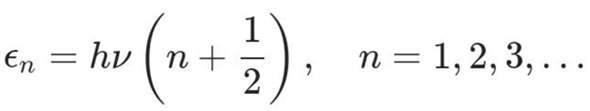
E = hv gilt nur für die Frequenz eines Photons, wie kann es sich hierbei um sogenannte Vibrationswellenzahlen von Molekülen handeln die ja komischerweise auch überall als cm^-1 angegeben sind??
2 Antworten

Die wellenzahl bei molekülschwingungen gibt an, wie viele schwingungen in einem zentimeter auftreten In deinem Fall bedeutet eine molekülschwingung von 2000 cm^-1, dass dass Wasserstoffmolekül 2000 schwingungen pro zentimeter hat. Es ist nicht so, dass das molekül tatsächlich in dem sinne "durch den Raum schwingt", sondern es zeigt an, wie schnell die Atome im molekül vibrieren Die Einheit cm^-1 wird verwendet, um die energie der schwingung auszudrücken, Die Formel für die erlaubten vibrationsenergieniveaus ist eine mathematische Beziehung, die verwendet wird, um die erlaubten energiezustände von schwingungen zu beschreiben. Die Variable "v" in der Formel steht für die schwingungszahl (nicht für die Geschwindigkeit), und die Einheit cm^-1 wird verwendet, um die energie der schwingung anzugeben Hoffe, dass klärt deine Fragen

Die Frequenz der Molekülschwingung ist dieselbe wie die des Lichtes, das sie anregt.
Wenn also ein Molekül 12 Trillionen mal pro Sekunde zappeln kann, dann kann man dieses Zappeln anregen, wenn man das Molekül mit Licht mit 12 Trillionen Herz bzw. ν=12 THz bestrahlt. Diese Licht hat dann eine Wellenlänge von λ=25 nm bzw. eine Wellenzahl von ν̃=1/λ=400 cm¯¹, wenn ich mich nicht verrechnet habe.
Schnell und ein klein wenig schlampig sagt man dann auch, daß das Molekül bei 400 cm¯¹ eine Schwingung habe, weil diese Schwingung im IR-Spektrum bei 400 cm¯¹ aufscheint.

Im einfachsten Fall reden wir von einem zweiatomigen Molekül. Das hat nur eine Schwingung und nur eine reduzierte Masse. Die Schwingungsfrequenz hängt von der reduzierten Masse und der Kraftkonstante ab, und beides ist für verschiedene Moleküle verschieden, und deshalb haben zweiatomige Moleküle Schwingungsfrequenzen zwischen 4400 cm¯¹ (132 THz, H₂) und 215 cm¯¹ (6.4 THz, I₂).
Mehratomige Moleküle sind komplizierter. Solange man sie als harmonisch annimmt, machen sie nicht viel Schwierigkeiten, weil man einen N-dimensionalen harmonischen Oszillator exakt als N eindimensionale harmonische Oszillatoren darstellen kann. Wenn aber Anharmonizität ins Spiel kommt, wird es sehr schnell sehr häßlich.
Jedes Molekül kann nur in seinen Eigenfrequenzen schwingen (außer, man regt es ständig von außen mit einer beliebigen Frequenz an).

Ich glaube zu meinen die Aussage
Die Frequenz der Molekülschwingung ist dieselbe wie die des Lichtes, das sie anregt.
Verstanden zu haben :-) Ich habe die Frequenz beim Molekül direkt als Energie interpretiert (was ja auch erstmal richtig ist) jedoch habe ich die Amplitude außer acht gelassen. In meinem Kopf war Frequenz direkt mit Schwingungsgeschwindigkeit verknüpft, doch darüber kann ich ja erst eine Aussage machen, wenn ich weiss wie stark das Molekül bei der Vibration auslenkt.
Ich kann einen Pendel haben mit einer hohen Frequenz aber winzigen Auslenkung oder einen mit derselben Frequenz aber großen Auslenkung (dieser hätte natürlich deutlich mehr Energie). Also wenn ein Photon mit der Energie hv in mein Molekül knallt schwingt mein Molekül mit der gleichen Frequenz was sehr praktisch ist weil man somit direkt die Energie mit hv wieder bekommt, die Auslenkung ist natürlich umso kleiner, je höher die reduzierte Masse ist wenn die Energie gleichbleibend ist.
Ich find's crazy das die Frequenz der molekülschwingung = Photonen Frequenz ist, immerhin hätte das Molekül ja auch mehr auslenken können aber dafür eine geringe Frequenz annehmen können, energetisch währe das ja gleichbleibend.

Falls du meine Schlussfolgerung bestätigen kannst ist nur noch mit den Worten von Jesse Pinkman aus der Serie Breaking Bad abschließen: YEAH fuck, Science!

- Resonanz: Energieübertragung zwischen zwei schwingenden Systemen (einer elektromagnetischen Welle und einem Molekül) tritt nur dann auf, wenn die Frequenzen zusammenpassen.
- Quantisierung: Die Quantenzahl v entspricht grob der klassischen Amplitude. Da v aber nur ganzzahlige Werte annehmen kann, kann ein Molekül nicht mit beliebig kleiner Amplitude schwinden.
- Ein Photon, dessen Frequenz zu keiner Schwingungsfrequenz des Moleküls paßt, wird einfach nicht absorbiert, sondern fliegt ungehindert weiter.

Aber wenn die energieübertragung nur im Resonanzfall funktioniert und so die amplitude (hier die Auslenkung des Moleküls beim schwingen) geändert wird, dann muss die Frequenz jedes gleichartigen moleküls ja gleichbleibend sein (Frequenz bleibt gleich, Amplituden sind unterschiedlich) ist es denn dann überhaupt möglich mit der Formel der erlaubten Energiezustände die Energie eines Moleküls alleine anhand seiner Vibrationsfrequenz \nu herauszufinden?
Immerhin fehlt ja die Information n, also in welchem potentiell vielfachen Energiezustand das Molekül durch seiner potentiell erhöhte Amplitude ist.

Wenn Du einen Haufen Moleküle derselben Art hast (z.B. F₂-Moleküle), dann befinden sich bei christlicher Temperatur die allermeisten davon im Grundzustand. Das heißt, der 0→1-Übergang ist der einzige, den Du so ohne weiteres anregen kannst. Fast alle absorbierten Photonen gehören also zur Energie des 0→1-Überganges.
Es ist aber auch möglich, daß für eine Schwingung bei Raumtemperatur bereits signifikant Population im v=1-Zustand vorhanden ist — vor allem bei größeren Molekülen, denn bei denen gibt es oft Schwingungen mit geringer Energie bzw. Frequenz. In diesem Fall kannst Du außer der 0→1-Absorption auch eine 1→2-Absorption beobachten. Für harmonische Oszillatoren wäre das natürlich ununterscheidbar, weil die Energieniveaux äquidistant sind, aber extrem niedrigfrequente Schwingungen sind typischerweise stark anharmonisch, also werden sich die beiden Absorptionen deutlich in der Wellenzahl unterscheiden.
Auch Obertöne sind möglich, also ein Übergang des Typs 0→2 etc. Für harmonische Oszillatoren sind sie verboten, aber Anharmonizitäten erlauben sie. Typischerweise sieht man Obertöne bei einer Wellenzahl knapp unterhalb des Doppelten des Grundtones, E(0→2) < 2⋅E(0→1).
Zuletzt gibt es sogar Kombinationsbanden, das Molekül absorbiert also ein Photon und regt damit mehrere Schwingungen gleichzeitig an. Auch das ist an Anharmonizität gekoppelt, und daher sind diese Absorptionen gewönlich sehr schwach.
All das was ich beschrieben habe, kann man mit etwas Glück oder Pech in einem Spektrum sehen (und die Komplikationen wegen Rotationszuständen habe ich unterschlagen). Es ist daher sehr schwierig, aus einem experimentellen Spektrum (meinst Du das mit „Vibrationsfrequenz \nu“?) das ganze Termschema mit allen Zuständen zu rekonstruieren, aber für nicht zu große Moleküle geht das, wenn man hochauflösend in der Gasphase messen kann und ggf. auch Raman zur Verfügung hat.

Danke :-) vielleicht noch eine letzte Frage: angenommen ich habe ein Molekül das sich nur bei Frequenz X anregen lässt. Jetzt habe ich einen Laserpointer der genau Frequenz X abstrahlt. Müsste ich jetzt einfach nur lange genug mit diesem Laserpointer auf das Molekül zielen um es so stark auslenken zu lassen das es dissoziert?

Also ich kann ja nicht die Photonen Energie erhöhen, weil das Photon dann ja eine höhere Frequenz besitzt und somit nicht mehr das Molekül das in gleichbleibender Frequenz in jedem Energielevel bleibt anregen kann.
Daher Frage ich mich, ob es dann einfach reicht ganz viele Photonen der gleichbleibenden Frequenz X hintereinander ins Molekül zu jagen um höhere vibrationszustände zu erreichen (Vorraussetzung ist natürlich das ein angeregter Zustand eine kurze Zeit bestehen bleibt und nicht sofort wieder in den Grundzustand zurückfällt)? Also einfach den Laserpointer zeitlich länger draufhalten? Oder was gibt es da noch für Möglichkeiten?

Und was mir gerade auch noch in den Kopf kommt, in der klassischen Mechanik muss ja auch die Phasenverschiebung passen um erregende Resonanz zu erzeugen. In der Quantenmechanik gibt es sowas gar nicht? Hier muss ja bloß die Frequenz passen. Hat das was damit zu tun das man in der Quantenmechanik eine Wellenfunktion hat und die Phasen irgendwie als Superpositionen auftreten?

Reale Moleküle sind anharmonisch, d.h., der 1→2-Übergang hat eine andere (typischerweise niedrigere) Energie als der 0→1-Übergang. Daher kannst Du mit einem Einstrahlenergie, die zum 0→1-Übergang paßt, das Molekül nicht zur Photodissoziation treiben. Das Maximum, das Du erzielen kannst, ist Gleichbesetzung der Zustände v=0 und v=1.
Wenn Du stattdessen mit der vollen Energie der Dissoziationsenergie einstrahlst, bekommst Du tatsächlich Dissoziation, allerdings meist mit geringer Ausbeute (der Übergang 0→∞ hat geringe Effizienz), und oft unspezifisch, d.h., es können mehrere Bindungen im Molekül geknackt werden, und man bekommt einen Sauhaufen an Spaltprodukten. Viel besser und kontrollierter ist es, wenn Du gleichzeitig die richtigen Energien für 0→1, 1→2, 2→3 etc bis (n−1)→n einstrahlst, und dann noch n→∞.
Angeregte Schwingungszustände leben leider nur sehr kurz, typischerweise Picosekunden. Wenn Du mit der Strahlung weggehst, ist sofort wieder fast alles im Grundzustand.
Kann ich mir schwer vorstellen, so ein Moleküle kann als Oszillator ja unterschiedlichste reduzierte Massen haben, wie kann da ein Photon genug Energie haben das dass Molekül mit deutlich höherer Masse genauso schnell schwingt?