Molare Reaktionsenthalpie und Literaturwert?
Hallo!
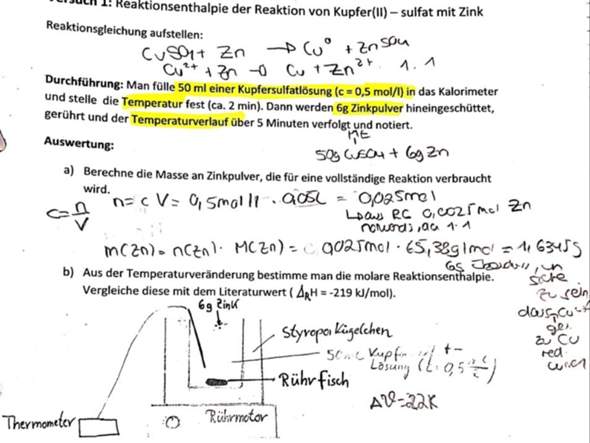
Ich komme mit der b) nicht weiter...was genau muss ich denn machen und wie genau?
1 Antwort
Vom Fragesteller als hilfreich ausgezeichnet

Von gutefrage auf Grund seines Wissens auf einem Fachgebiet ausgezeichneter Nutzer
Schule, Chemie
Dafür brauchst du die "Kalorimeterformel".
Da für dein Kalorimeter nichts angegeben ist, lautet diese Formel für dich:
Enthalpie = cp(Wasser) • m(Wasser) • DeltaTheta
- DeltaTheta = 22K
- cp(Wasser) = Wärmekapazität von Wasser (=> 4,186 [J/(g•K)])
- m(Wasser) = Masse von Wasser. Nimm dafür einfach näherungsweise 56g. Das entspricht dem ganzen Krempel, der da drin rumschwimmt.
Muss los...

@mrknowledgefr
Muss ich nciht noch was mit der Stoffmengr berechnen?

Miraculix84
07.10.2020, 20:08
@mrknowledgefr
Ja genau. Bin jetzt auch wieder zu Hause. ;)
Du hast 0,05L • 0,5mol/L = 0,025mol eingesetzt. Mit anderen Worten: Das war 1/40mol Kupfer.
D.h. das Ergebnis aus der Kalorimeterformel musst du mit 40 multiplizieren, um einen molaren Wert zu erhalten.
Alles klar?
PS: Am Ende hast du dann etwa 200KJ/mol raus, wenn ich das richtig überschlage. Das ist bei einem Lit.-Wert von 219 gar nicht mal so übel...
LG
Vielen Dank!