Ist dieses Molekül ein Dipol?
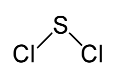
Und wieso?
3 Antworten

Moin,
es kommt darauf an, welche Skala der Elektronegativität du verwendest. Aber der Reihe nach...
Ein permanenter Dipol entsteht, wenn zwei Bedingungen auf ein(en) Molekül(bereich) zutreffen: erstens müssen die Bindungspartner so verschiedene Elektronegativitätswerte aufweisen, dass zwischen ihnen eine polare Atombindung entsteht.
Aber dann muss zweitens auch eine Molekülgeometrie vorliegen, die dafür sorgt, dass die Schwerpunkte der entgegengesetzten Teilladungen (Partialladungen) sich auf zwei gegenüberliegende Molekülbereiche verteilt.
Letzteres ist beim Schwefeldichlorid gegeben, denn das Molekül ist gewinkelt gebaut. Wenn du dir das Molekül grob als Kugel vorstellst, gibt es einen „Pol”, wo das Schwefelatom mit seinen beiden freien Elektronenpaaren sitzt (die „Spitze” des Winkels), und einen anderen „Pol”, wo sich die beiden Chloratome mit ihren jeweils drei freien Elektronenpaaren befinden (die „Enden der Schenkel” des Winkels).
Wenn also das Schwefelatom eine Partialladung durch eine polare Atombindung zu den beiden Chloratomen hätte und die beiden Chloratome eine entgegengesetzte Partialladung aufweisen würden, dann wäre es ein permanenter Dipol.
Aber bei der ersten Voraussetzung gibt es Probleme...
Nach der Allred-Rochow-Skala für Elektronegativitäten beträgt die
EN(S): 2,44
EN(Cl): 2,83
Damit ist die EN-Differenz (2,83 –2,44 =) 0,39
Nach einer Faustregel liegen Bindungen mit einer EN-Differenz zwischen 0 und 0,4 innerhalb normaler „Dichteschwankungen” in der Bindungselektronenverteilung und sind deshalb unpolar (sie auch die Bindungen zwischen Wasserstoff- und Kohlenstoffatomen).
Nach der Pauling-Skala betragen die EN-Werte allerdings
EN(S): 2,58
EN(Cl): 3,16
und die EN-Differenz somit (3,16 – 2,58 =) 0,58
Hier wäre also eine leicht polare Atombindung zu unterstellen.
Im ersten Fall (Allred-Rochow) ist Schwefeldichlorid kein Dipolmolekül, weil die Bindungen zwischen dem Schwefelatom und den Chloratomen nicht polar genug ist.
Im zweiten Fall ist das Molekül ein permanenter Dipol, weil es (leicht) polare Atombindungen hat und seine gewinkelte V-Geometrie dafür sorgt, dass die entgegengesetzten Partialladungen diametral liegen (zwei entgegengesetzt teilgeladene Pole = Dipol).
LG von der Waterkant

Zwei unterschiedliche Atome haben immer unterschiedliche Elektronegativitäten. Das heißt eines muss immer stärker anziehen als das andere. Da das Molekül gewinkelt ist und nur zwei unterschiedliche Atome beherbergt muss es in jedem Fall auch ein Dipolment haben

Das Molekül ist gewinkelt, im Gegensatz z. B. zum C02. Die Chloratome ziehen die Elektronen stärker zu sich als das Schwefelatom. Deshalb ist das Molekül polar.