Frage zu Molekülorbitalen?
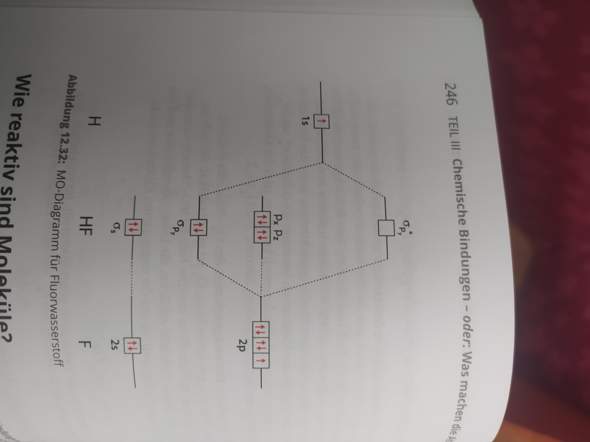
Wenn es zwei unterschiedliche Atome sind, woher weiß man dann, auf welcher Höhe man die Atomorbitale hinzeichnen muss? Wieso ist z.B das 1s Orbital von H energetisch höher als das 2s und 2p Orbital von F? Ich dachte energetisch ist 1s<2s<2p?
Und wo ist das 1s Orbital von F, wieso hat das keins?
1 Antwort

Die Höhe der Orbitale ist relativ willkürlich, es gibt nur ein paar Grundregeln zu beachten:
1. Die antibindenden MOs liegen normalerweise etwas weiter oben als die bindenden tief liegen.
2. Die AOs (und damit auch die MOs die daraus entstehen) liegen umso tiefer je elektronegativer das Atom ist, an dem sie sitzen (siehe bei dir H vs F)
3. Es wechselwirken immer die Orbitale miteinander, die energetisch und symmetrisch am kompatibelsten sind.
4. Man legt die Orbitale so, dass das Gesamtbild überschaubar ist und nicht zu eng z.b.
Und wo ist das 1s Orbital von F, wieso hat das keins?
Das hat sehr wohl eins. Nur liegt das in der Energie so tief, dass es für Reaktionen irrelevant ist und daher nicht eingezeichnet wird. Man könnte das 2s aus demselben Grund hier auch weglassen.