Dissoziation von Ammoniak?
Bei welchem Ph wert sind die Ammonium Ionen zu 50% deprotoniert, wenn die NH4Cl-Lösung eine Konzentration von i. 0,010 mol/l und ii. 0,0010 mol/l aufweist. Stellen Sie hierfür das MWG auf und begründen Sie Ihre aussage rechnerisch. pKB(NH3)=4,75
Kennt sich eventuell hier mit jemand aus, habe überhaupt keine plan😅?
2 Antworten

Ammoniak/Ammonium sind immer bei pH=9.25 zur Hälfte protoniert bzw. deprotoniert. Das ist unabhängig von er Konzentration.
Warum das so ist, kann man am Massenwirkungsgesetz sehen. Dabei ist es egal, ob wir die Säurereaktion des Ammoniums oder die Basenreaktion des Ammoniums betrachten, ich nehme einfach letzteres:
NH₃ + H₂O ⟶ NH₄⁺ + OH⁻
Wenn der Protonierungsgrad 50% betragen soll, dann muß genau gleich viel NH₃ wie NH₄⁺ vorliegen, also kann man die beiden gegeneinaner kürzen:
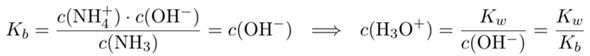
und daraus kann man leicht den pH berechnen:
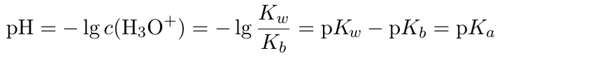
wobei pKₐ für die Säurekonstante des Ammonium-Ions (konjugierte Base von NH₃) steht, und pKw≈14 weil Kw≈10⁻¹⁴ mol²/l² (bei 25 °C).
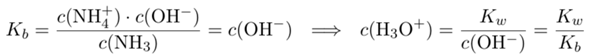
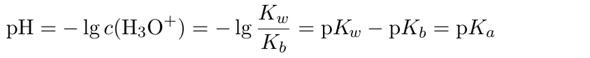

Das zeigt dir der pKs-Wert. Da ist das Verhältnis S:B = 1:1 = 50%:50%
Es gilt: pKw = pKs + pKb = 14
der pKb-Wert ist gegeben. Damit kannst du den pKs-Wert ausrechnen.
pKs = pH