Dipol in einem Fettmolekül
Hallo!
Bei einem Fettmolekül, das ja ein Fettsäureglycerinester ist, gibt es ja immer ein C-Atom, das mit einer Doppelbindung mit einem O-Atom verbunden ist. Dies ist ein Dipol (ist das richtig?). und dieses C-Atom ist mit einem weiteren O-Atom verbunden (Einfachbindung). Ist dies jetzt auch ein Dipol, an dem sich Dipol-Dipol-Wechselwirkungen ausbilden können?
Falls ihr ein Bild von einem Fettmolekül benötigt, hier ist die Grafikadresse zu einem: http://www.mennel.net/chemie/images/fett.gifbzw. ich hab dieses Bild auch hinzugefügt.
Vielen Dank schon mal :)
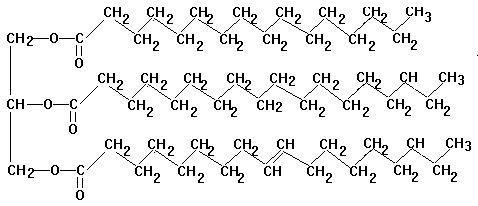
3 Antworten

Die Bindungen zwischen C und O sind zwar polar, die Doppelbindungen ganz besonders, und es können sich dort auch Wechselwirkungen ausbilden, aber das Glycerin-Teil ist im Zentrum und abgeschirmt von den unpolaren Resten der langen Ketten.
ZB werden die H-Atome dort im Kernresonanzspektrum ein wenig(!) verschoben, macht sich chemisch aber kaum bemerkbar, diese Gruppen sind sozusagen "eingewickelt", wenn auch mit einer "lochrigen Folie" (so als Hilfsvorstellung)
Erst, wenn das Molekül teilverseift wird (also ein oder zwei Esterbindungen am Glycerin gespalten werden), ergeben sich freie Alkohol-Gruppen am Glycerin, die H-Brücken ausbilden. Interessanterweise wirken sie noch nicht Schaum-bildend, sondern Schaum-zerstörend (Entschäumer).
Die abgespaltenen Fettsäuren dagegen sind auch polar und können H-Brücken bilden am einen Ende, so richtige Seifen werden sie aber erst, wenn sie eine ganze Ladung tragen als Salz (Na+: Kernseife, K+: Schmierseife, letzteres, weil das größere, aber auch nur einmal geladene Kalium kein so fest bindendes Ion ist) . Echte Seifen sind also nur im -mindestens schwach-Alkalischen wirksam: Wasch-"Lauge".

Dankeschön. Aber was alles verstehst du als "Glycerin-Teil" und was hat es für eine Auswirkung, dass es von den unpolaren Ketten abgeschirmt ist? Und was bitteschön ist das "Kernresonanzspektrum"?

Nicht die Bindung ist der Dipol, sondern das gesamte Molekül. Die Bindung ist evtl. polar (das ist im beschriebenen Fall so, und zwar immer, wenn Atome mit unterschiedlicher EN miteinander verbunden sind).
Aus der Geometrie des Moleküls und den einzelnen Partialladungen kann man abschätzen, wie stark polar das Molekül ist.

Hallo. Dankeschön schon mal. Sehe ich das jetzt richtig, dass das O, das an der Doppelbindung "hängt", die Partialladung "delta minus" hat, und das C "delta plus". Aber hat das O an der Einfachbindung auch eine Partialladung? Die müsste dann ja auch "delta minus" sein.
und kann dieses O an der Einfachbindung Dipol-Dipol-Wechselwirkungen ausbilden oder nicht? Ich würde jetzt mal sagen nein, aber ich habe keine Erklärung dafür...

Der Dipolcharakter der veresterten Carboxylgruppe ist sehr schwach. Selbst kurzkettige Karbonsäureester sind schlecht wasserlöslich. Bei den Fetten sorgen die langen Alkyreste dafür, dass sie praktisch in Wasser unlöslich sind.

Dankeschön. Aber gibt es im Fettmolekül nicht nur eine Carbonyl-Gruppe und keine CarboXyl-Gruppe?