Chemie Stöchiometrie Aufgabe? 100ml Wasserstoff?
Guten Abend,
In meiner Klasse ist das thema stöchiometrie dran und ich habe folgende Hausaufgabe:
“Ein mit 100ml Wasserstoff befüllter Ballon wird entzündet. Berechne die Masse des entstehenden Wassers.“
Mein Ansatz:
V/V(m)=n
V = 100
Vm = 24 unter normalbedingungen
Mn = m —> 1 4,16 = 4,16mg H2
Dann die sauerstoffmenge durch 2
H-O-H
Wieder Mn = m
16* (4,16/2) = 33,3mg
und dann 4,16+33,3 = Wassermasse?
Ist das so richtig?
Blicke nicht ganz durch😅
Danke im vorraus!
3 Antworten

Wir wissen erst einmal, dass der Wasserstoff, welcher im Ballon enthalten ist mit dem Sauerstoff aus der Luft reagiert, wobei wir folgende Reaktionsgleichung aufstellen können:
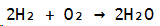
Zudem können wir die Stoffmenge des Wasserstoffes berechnen, wobei in meinem Beispiel von einem idealen Gas, einer Raumtemperatur von 25°C (298,15K) und einem Druck von 101,325kPa ausgegangen wird.
Als erstes errechnen wir das molaren Volumen, welches uns angibt, wie viel Liter an Volumen ein Mol eines ideales Gases bei den zuvor gegebenen Bedingungen einnimt.
R ist hierbei die universelle Gaskonstante, welche ungefähr 8,314472 beträgt.
Diese sollte in jedem guten Taschenrechner enthalten sein.
Nun können wir mithilfe des ausgrechneten molaren Volumens die Stoffmenge von 100ml = 0,1l Wasserstoff berechnen.
Aus unserer Reaktionsgleichung geht zudem hervor, dass das Stoffmengenverhältnis von H2 zu H2O 1:1 ist.
Das heißt, dass n(H2) = n(H2O) ist, weswegen wir nun problemlos die Masse des Wassers berechnen können, wobei wir zuvor die molaren Masse des Wassers errechnen müssen.
Nun können wir hierraus die Masse des entstandenen Wassers berechnen, indem wir die Stoffmenge mit der molaren Masse multiplizieren.
Nun wissen wir, dass ungefähr 73,573 Milligramm an Wasser bei der Verbrennung von 100ml Wasserstoff entstehen.
~Johannes
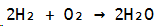


Aber kann ich nicht theoretisch auch wenns unständlicher ist, die masse von dem beteiligten Wasserstoff mit der vom Sauerstoff zusammen addieren?
weil ich ja weiß, dass die halbe menge sauerstoff reagiert?
oder bin ich gerade verwirrt.

Geht auch, da der Massenerhaltungssatz gilt.
Kannst es gerne mal schicken, wie du es gemacht hast. :)
~Johannes

Ein formaler Fehler:
V = 100
ist mangels Einheit falsch. Auch das Molvolumen und die Molmasse haben eine Einheit.
Ein echter Fehler: Die Molmasse von H2 ist 2 g/mol.

Ich blick bei Deiner Rechnung nicht durch, richtig geht’s folgendermaßen: Du hast 100 ml H₂, das sind n=V/Vₘ=4.2 mmol, beim Verbrennen wird dieselbe Stoffmenge Wasser gebildet, also m=n⋅M=75 mg, das entspricht einem großen Tropfen.
Vielen dank.. sorry für meine dumme frage😅