Chemie: Indikatorfarbe anhand von pH-Wert und Strukturformel bestimmen?
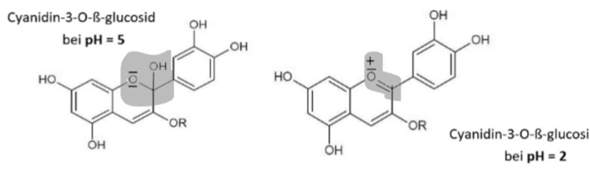
Wie kann man hier feststellen, wann der Farbstoff farblos ist? Spielt der dritte Benzolring noch eine Rolle im konjugierten Doppelbindungssystem oder ist das durch die ,,Entfernung" nicht möglich? Und müsste die Form von pH2 nicht protonierter sein als die von pH 5, dabei enthält sie sogar ein H -Atom weniger?
1 Antwort

Je größer das aromatische System, desto größer ist auch die Wellenlänge bei der es absorbiert. Bei der Form bei pH = 2 hast du durch die zusätzliche π-Bindung nun Kontakt zum dritten Ring hergsetellt und damit das aromatische System vergrößert. Das sollte also die farbige Form sein.
Die Protonierung läuft hier etwas anders als "nur" ein H+ ins Molekül einzuführen. Am markierten Teil des Moleküls nimmt die OH-Gruppe ein Proton auf und kann sich danach als H2O abspalten. Der Sauerstoff im Ring füllt nun die elektronische Lücke die am OH-Kohlenstoff hinterlassen wurde, indem er mit einem seiner freien Elektronenpaare eine π-Bindung zum C bildet.

Ja, aber das liegt erstmal nur an der Größe des π-Systems. Die Auxochrome verschieben dir nur die Absorptionwellenlänge bathochrom, also ins rotere.
Da das System bei pH 5 so klein ist, wird es wahrscheinlich irgendwo im UV-Bereich absorbieren.

Dann habe ich kurz gesagt bei pH 5 also nur zwei Ringe und bei pH 5 drei? Das macht natürlich Sinn... vielen lieben Dank

Du hast bei beiden Formen drei Ringe, nur sind deren π-Systeme beim pH 2 halt verbunden, bei pH 5 nicht
Ah vielen Dank, dann kann also bei der Form von pH =2 ein pi-Elektronenpaar ,,zwischen" die beiden Ringe klappen und so können neue Mesomerieformen entstehen, die die Wellenlänge erhöhen? Und bei pH 5 ist es dann farblos, weil ich ein kleineres System habe und es nur eine auxochrome, aber keine antiauxochromen Gruppen gibt?