Chemie Bindungselektronen?
Wenn zwei Atome durch eine Elektronenpaarbindung verbunden sind, "gehört" das Elektron des einen Atoms dann auch dem anderen Atom? Zählt es dann auch zu seinen Außenelektronen?
2 Antworten

Kovalente Bindung
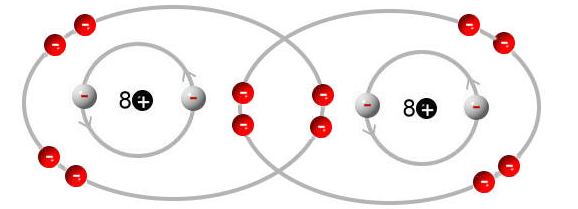
Wenn zwischen Atomen einen kovalente Bindung (Elektronenpaarbindung) vorliegt, so werden die Bindungselektronen gemeinsam genutzt.
Das Ganze kann man vereinfacht folgendermaßen im Schalenmodell darstellen:
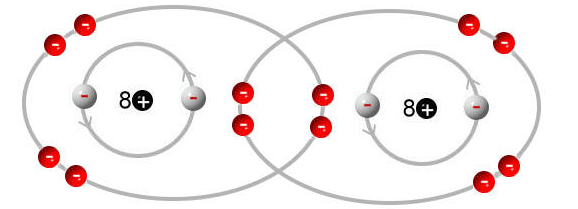
Durch das gemeinsame Nutzen der Bindungselektronen, erreichen beide Atome die Edelgaskonfiguration, da sie beide 8 (Wasserstoff, Helium, Lithium, ... brauchen nur 2) Valenzelektronen (Elektronen in der äußersten Schale) besitzen.
Ladung
Durch die gemeinsame Nutzung der Elektronen, erhält keines der Atome eine Ladung, wie @Spikeman197 bereits erwähnt hat, da das Verhältnis zwischen Protonen (8 + 8) und Elektronen (8 + 8) 1:1 ist und somit kein Defizit oder Überschuss an negativer Ladung vorliegt.
Van-der-Waals-Wechselwirkung
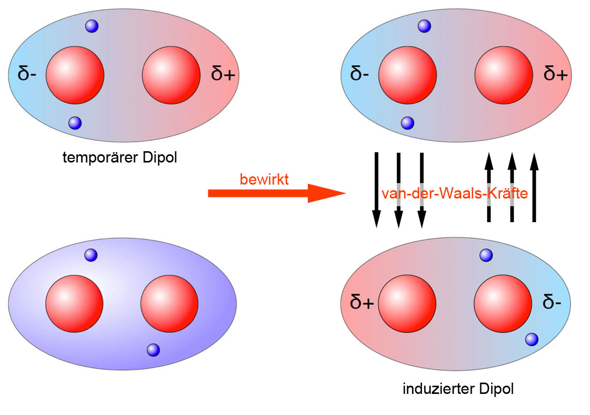
Dennoch kann es dazu kommen, dass die Elektronen kurzzeitig asymmetrisch verteilt sind, wodurch ein temporärer Dipol zustande kommen würde, welcher Dipole induzieren kann.
Diese Wechselwirkung wird auch Van-der-Waals-Wechselwirkung genannt, welche aber nicht mit der Ionenbindung vergleichbar ist, da dort der Ladungsunterschied um einiges größer ist, da dort ganze Elektronen übertragen wurden und ein tatsächliches Ungleichgewicht zwischen Elektronen und Protonen vorliegt.
Die Van-der-Waals-Wechselwirkungen kann man sich folgendermaßen vorstellen:
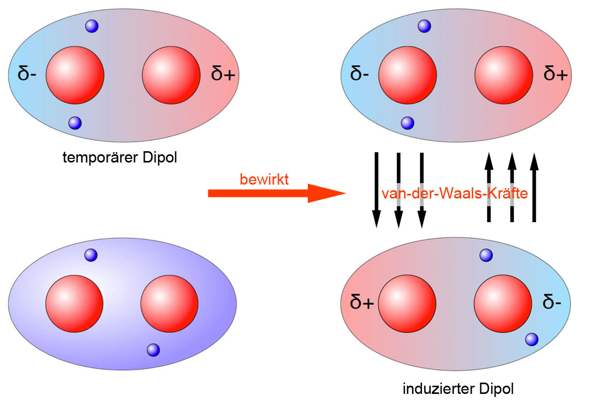
(Quelle: https://www.u-helmich.de/che/lexikon/V/van_der_Waals.html)
Im oben genannten Beispiel ist ein Wasserstoffmolekül zu sehen, wobei die vorliegende Bindung unpolar ist.
Ob eine Bindung unpolar ist, kann man ungefähr an der Elektronegativitätsdifferenz festmachen, wobei bei einer Differenz von circa 0 - 0,5 unpolare Elektronenpaarbindungen vorliegen.
Die Elektronegativitätsdifferenz zwischen zwei gleichen Atomen ist 0.
Polare Moleküle
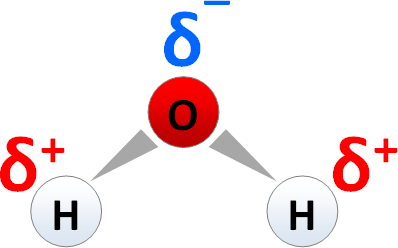
Polare Elektronenpaarbindungen liegen vor, wenn die Elektronegativitätsdifferenz circa 0,5 - 1,7 beträgt, wobei dies unter anderem beim Wassermolekül der Fall ist, da es einerseits nicht linear ist und andererseits das Sauerstoffatom eine Elektronegativität von 3,5 aufweist, während das Wasserstoffatom eine Elektronegativität von 2,1 aufweist.
Hierbei ist die Differenz 1,4.
Man kann es sich so vorstellen, dass das Sauerstoffatom die Elektronen näher zu sich zieht, weswegen dieses auch partiell negativ geladen ist, während das Wasserstoffatom dann partiell positiv geladen ist.
Das Ganze würde dann folgendermaßen aussehen:
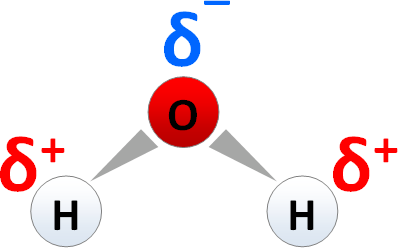
(Quelle: http://www.bs-wiki.de/mediawiki/index.php?title=Polarit%C3%A4t)
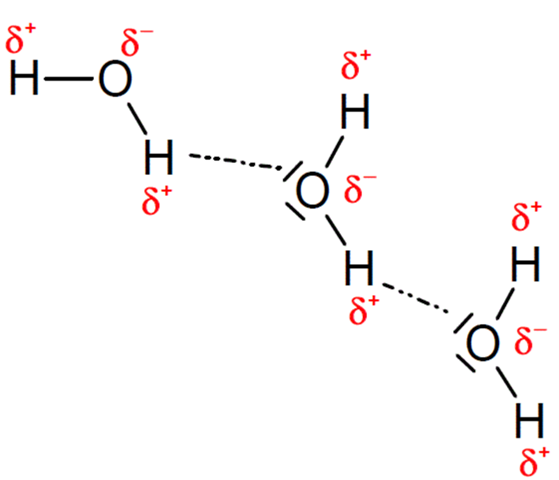
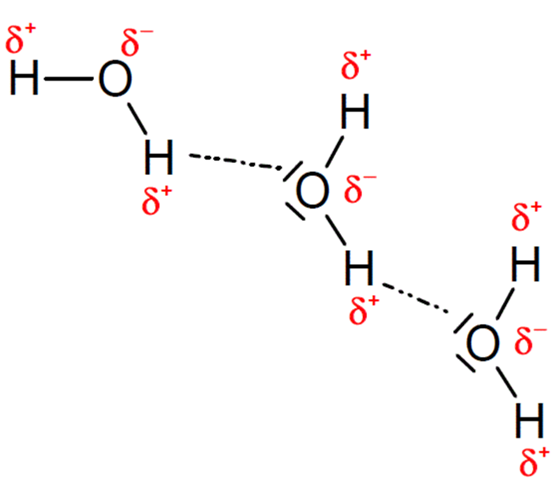
Zwischen polaren Molekülen können auch Dipol-Dipol-Wechselwirkungen vorliegen beziehungsweise Wasserstoffbrücken, welche eine spezielle Dipol-Dipol-Wechselwirkung sind und auch für den Zusammenhalt zwischen einzelnen Wassermolekülen verantwortlich sind.
Ich bin jetzt zwar etwas abgeschweift, aber generell gilt, dass zusätzliches Wissen nie schadet. :)
~Johannes

Ja, es zählt zur Erfüllung der Oktett-Regel, oder Edelgas-Konfiguration dazu! Allerdings NICHT für die Bestimmung einer Ladung.