Chemie?
Hey,
weiß jemand wie man das rechnet?
Berechnen Sie, welche Stoffmenge im Gleichgewicht vorliegt, wenn man bei dieser Reaktion von 1 mol Ethansäure und 1 mol Ethanol ausgeht. Gleichgewichtskonstante K=4
1 Antwort

Ethanol + Essigsäure ⟶ Wasser + Ester
Wir setzen gleiche Mengen n₀=1 mol der Edukte ein; ein Teil x davon wird reagieren und Produkt ergeben. Im Gleichgewicht haben wir also je x mol Ester und Wasser, und n₀−x mol Alkohol und Säure. Diese Erkenntnis können wir ins Massenwirkungsgesetz einsetzen und nach x auflösen:

Wir bekommen also je ⅔ mol Ester und Wasser, und je ⅓ mol Alkohol und Säure bleiben im Reaktionsgemisch übrig.
(Falls Du Dich fragst, warum ich die Stoffmengen und nicht die Konzentrationen im Massenwirkungsgesetz verwende: Das kann man in diesem Fall machen, weil im Zähler und Nenner gleich viele Konzentrationen c=n/V vorkommen und sich das Volumen folglich herauskürzt)
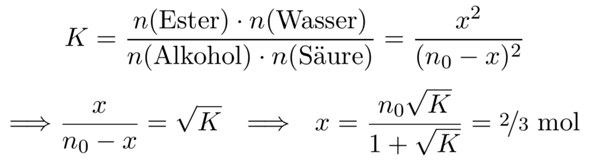

Multipliziere die Gleichung links in der zweiten Zeile mit dem Nenner:
x = (n₀−x)√K = n₀K − x√K ⟹ x + x√K = x(1+√K) = n₀√K
und jetzt mußt Du nur noch durch (1+√K) dividieren.
Ich verstehe diesen Schritt noch nicht ganz -->x/n0 -x = √K --> x = n0√K/1+√K=2/3 mol