bestimmung stickstoffgehalt kjeldahl
hallo community, ich habe heute ein experiment zur bestimmung der stickstoffmenge nach kjeldahl durchgeführt und jetzt muss ich noch die besagt menge berechnung und werde da leider nicht wirklich fündig... bin jetzt auch nicht so der chemie-profi.... hier kurz der ablauf: -alanin mit schwefelsäure versetzt und einaschen lassen -lösung mit a.dest. auf 25ml aufgefüllt, zentrifugiert -5ml der lösung in parnas-wagner-apperatur mit 5ml naoh und drei tropfen phenolphtalein in borsäure (10ml) auf ca.25ml überdestilliert -in destillat 1 tropfen tashiro-mischindikator und mit hcl titriert (insegsammt 21,75ml) ich habe nur gelesen, dass die verbrauchte maßlösung in die stickstoffmenge umgerechnet werden kann... das hilft mir aber nicht sehr viel weiter. habt ihr vielleicht ne seite, wo man das gut nachlesen kann?
2 Antworten

Das habe ich erst vor kurzem im Praktikum gemacht, allerdings haben wir die Probe etwas anders aufgearbeitet.
Was abläuft ist ja quasi, dass du den Stickstoff dazu bringst, dass er am Ende als Amoniak vorliegt bzw. nach der Wasserdestilation als Ammoniumsalz (NH4+, B(OH)4-), die verbrauchte Maßlösung sollte also dem Gehalt dieses Salzes entsprechen. Alles vorher dient nur dem Aufschluss, da die Stickstoffbindung ziemlich stark ist muss man da eben etwas Aufwand betreiben.
Bei der Titration schließlich sieht es so aus:
NH4+ + B(OH)4- + HCl → NH4Cl + B(OH)3 + H2O
Die verbrauchte Menge HCl ist also die Menge NH4+ (1:1), dementsprechend muss man zum rechnen nur noch den Massenanteil von N bestimmen. Da wir mit H2SO4 statt Borsäure gearbeitet haben bringt dir mein Rückrechnungsfaktor leider nichts. Zudem hatten wir vor der Destilation Maßlösung vorgelegt, daher musste man noch eine Differenz bilden um den tatsächlichen Verbrauch zu ermitteln, aber wenn ich deine Anleitung richtig lese sollte das bei euch nicht nötig sein.

Ich hab Kjeldahl nie gemacht, nimm das also mit Vorsicht.
Im Wesentlichen hast Du Deine Probe mit H₂SO₄ aufgeschlossen, den Sticki mit NaOH in Ammoniak überführt und in die Borsäure eingeleitet. Wenn ich das richtig verstehe, ist die Borsäure in der Vorlage, nicht im Destillationskolben.
Der Ammoniak reagiert nun mit der Borsäure
B(OH)₃ + NH₃ + H₂O ⟶ NH₄B(OH)₄
(kann auch ein anderes Borsäure-Salz sein, das sich dabei bildet; das ist alles empfindlich von Konzentration und pH abhängig). Du kriegst eine eine gewisse Menge Borat, und der Rest Borsäure bleibt übrig.
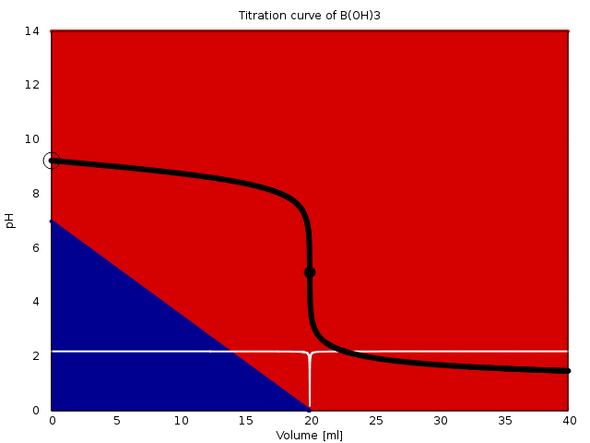
Und diese Suppe hast Du dann mit Salzsäure titriert (welche Konzentration)? Die Titration müßte ungefähr so aussehen wie das angehängte Bild (da titriere ich eine Borsäure/Borat-Lösung [je 0.1 mol/l] mit 0.1 mol/l Salzsäure). Offenbar hast Du Indikator genommen und keine pH-Elektrode. Dieser Tashiro-Indikator schlägt angeblich bei pH 5 um, also paßt das zu dem, was ich ausgerechnet habe.
Mit der Salzsäure titrierst Du das Borat. Jedes Borat-Ion zeigt Dir an, daß ein Stickstoff-Atom in der Probe war. Die Stoffmenge Salzsäure (Konzentration der Maßlösung mal verbrauchtes Volumen) ist also gleich der Stoffmenge Ammoniak in Deiner Destillation. Diese Stoffmenge kannst Du also sofort in Milligramm Ammoniak oder auch Alanin umrechnen, mußt aber noch bedenken, daß nur ein Fünftel (5 von 25 ml) Deiner Proble letztlich titriert wurde, die anderen vier Fünftel blieben unbearbeitet im Schrank zurück.
Alles klar?

c(HCl)=0,01mol/l*0,02175l=0,0002175l=0,2175ml stimmt das so?? :)
Das kannn ja nicht mal einheitenmäßig drauf hin kommen. ;-)
Die Stoffmenge verbrauchte Salzsäure ist 0.01 mol/l * 21.75 ml = 0.2175 mmol. Dieselbe Menge Stickstoff (=NH₃) war in Deiner Destillation. In der ganzen Probe fünfmal soviel (Du hattest ja nach dem Säureaufschluß auf 25 ml aufgefüllt und mit nur 5 ml weitergearbeitet). Also reden wir von 1.0875 mmol Stickstoff in der ganzen Probe.
Wahrscheinlich sollst Du das am Ende in Masse angeben. Das entspricht wahlweise 15.2 mg Stickstoff, 18.5 mg Ammoniak oder 96.9 mg Alanin, nach der Formel m=n*M.
Ich hab die Titrationskurve nochmals gerechnet, mit Deinen Angaben. Leider weiß ich immer noch nicht, wie stark die Borsäure in der Vorlage war (das hat keinen Einfluß auf die Berechnung des N-Anteils, aber bescheidene Auswirkungen auf den pH während der Titration). Ich kann die Kurve hier nicht posten, weil Bilder in Kommentaren nicht erlaubt sind, aber es sieht ungefähr so aus wie die anfangs gezeigte, nur mit weniger steilem Sprung: Der Anfangs-pH liegt etwa bei 8, der Sprung liegt bei 5.3, und der End-pH bei 2.5. Paßt also gut zu Deinem Indikator.
ui was für eine kompetente aussage^^also:
ja genau, die borsäure war nicht in der anlage. in die borsäure wurde das aus der anlage destillierte ammoniak wieder aufgefangen. also so hab ich das zumindest verstanden :)
und genau das habe ich denn titriert. zuerst war es nach zugabe des tashiro-indikators grün und nach 21,75 ml schlug es um zu grau. achja und HCl hat die konzentration von 0,01mol/l
und eine titrationskurve haben wir leider nicht angefertigt.
und um auf deine rechnung zurück zu kommen:
c(HCl)=0,01mol/l*0,02175l=0,0002175l=0,2175ml stimmt das so?? :)