Arsentrifluorid Lewis Schreibweise?
Hallo,
Ich weiß nicht ob ich das richtig gemacht habe aber es ist sinnvoll Weil es die oktettregel erfüllt die trigonal planar und es hat freie Elektronenpaare
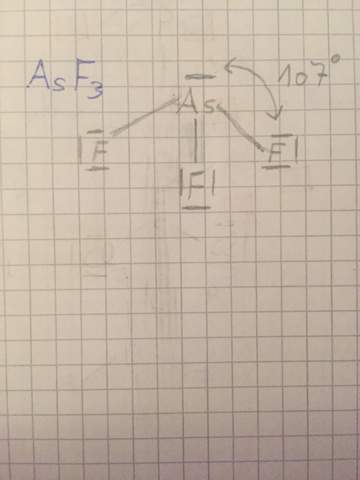
im Internet steht das diese Struktur so aussieht
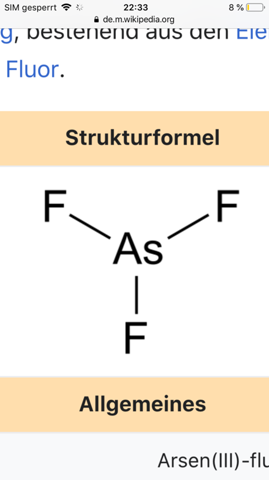
ich verstehe nicht wieso arsen keine freien Elektronenpaare hat wen arsen 5 außenelektronen hat ? Wohin gehen den diese 2 Elektronenpaare hin bei Verbindung mit trifluorid Wo ist die oktettregel ? Wo sind sie elektronenpaare ? Und die Trigonal planar ?
2 Antworten

Du hast doch selbst den Bindungswinkel F-As-F notiert, 107 °. Also ist die Stuktur trigonal pyramidal und nicht trigonal planar, dann wären's 120 °. Die Gesamtstruktur, incl. freiem Elektronenpaar, ist dann annähernd tetraedrisch, der Tetraederwinkel ist ca. 109 °.
Du hast also alles richtig, bis auf dass du den Winkel falsch eingezeichnet hast. Das ist, wie gesagt, der im Dreieck F-As-F, nicht zwischen F und freiem Elektronenpaar. Die Atomkerne kann man mit Röntgenbeugung sehr genau vermessen, schon daher gibt man deren Lage an.


Ich bin mir jetzt bei Arsen nicht so sicher, aber ich meine es gibt diesen Inert-Pair effekt. Der besagt, dass das freie Elektronenpaar (s-Orbital) energetisch deutlich niedriger liegt (also auch näher am Kern ist, weil zwischen s und p Orbitalen noch die d Orbitale liegen) als die p-Orbital Elektronen, die die Bindungen eingehen. Damit hätten die Elektronen im s-Orbital keinen sterischen Anspruch, sodass eine trigonal planare Form möglich ist.
Müsstest du vllt selbst nochmal recherchieren

Der Inert-Pair-Effekt macht sich erst in der 6. Periode deutlich bemerkbar.
