Wenn ein Molekül polar ist, so hat das Molekül verschiedene Teilladungen.( ein Teil ist positiv geladen, der andere wegen der stärkeren elektronenanziehung positiv geladen). Wasser hat ebenfalls zwei verschiedene Teilladungen. Die Wasserstoffatome haben eine positive Teilladung, das Sauerstoffatom, wegen der stärkeren Elektronenanziehung eine negative Teilladung. Und da sich polare Moleküle wegen der unterschiedlichen Teilladung anziehen, ist ein polares Molekül hydrophil( also wasserliebend).
Bei unpolaren Molekülen ist es genauso. Unpolare Stoffe haben keine ausgeprägten Teilladungen, sodass sie lipophil sind, also öl-liebend. Und Fette/ÖL bestehen aus aneinandergereihten C-Atomen, die unpolar sind.
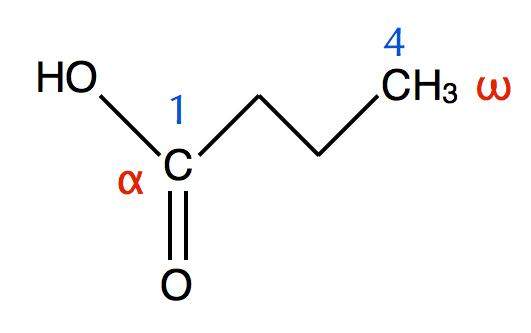
Buttersäure oder Butansäure:
Butansäure ist eine farblose, übel riechende Substanz mit einem Schmelzpunkt von -5 ºC (ist also bei Zimmertemperatur flüssig) und einem Siedepunkt von 163 ºC sowie einer Dichte von 0,96 g/cm3. Sie ist mischbar mit Wasser weil sie polaren Charakter hat, da sich die hydrophile (wasserliebende) Carboxylgruppe durchsetzt. und unpolaren Lösemitteln wie Diethylether.
hydrophil bedeutet wasserliebend, eine Affinität sich in Wasser lösen zu können, hydrophob ist genau das Gegenteil, also Fette sind hydrophob. Carbonsäuren enthalten in ihren Molekülen Carboxylgruppen (-COOH), welche sie ihren Säurecharakter verdanken. Die O-H-Bindung in der Carboxylgruppe ist durch den negativen induktiven Effekt der mit ihr verbundenen Carbonylgruppe stärker polar als in den Phenolen; die gegenüber der Carbonsäure erhöhte Stabilisierung des Anions durch Mesomerie erschwert zudem die Anlagerung des Protons an das Carboxylat-Anion. Umgekehrt bewirken elektronegative Atome oder Atomgruppen eine Verstärkung der Polarität der O-H-Bindung und erhöhen somit die Säurestärke. Trichloressigsäure oder gar Trifluoressigsäure sind in ihrer Stärke durchaus mit den starken anorganischen Säuren vergleichbar.
das ist das Molekül der Buttersäure: