Guten Morgen,
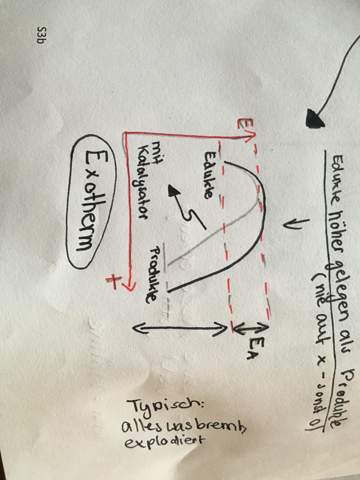
kann mir jemand dabei helfen, das Enthalpie-Diagramm perfekt zu verstehen? Zwar verstehe ich vieles schon, aber das würde mir trotzdem sehr helfen.
Wie kommt man hier überhaupt auf Delta H? Wieso ist Delta H > 0 gleich endotherm und Delta H < 0 gleich exotherm? Was bedeutet es überhaupt, wenn Delta Reaktionsenergie größer oder kleiner als 0 ist. Was hat es mit der 0 auf sich? Was ist, wenn Delta Reaktionsenergie 0 ist? Was hat es mit der Aktivierungsenergie auf sich? Wieso ist diese bei endothermen Vorgängen nur der obere kleine Teil, obwohl das Diagramm zuvor schon zunimmt? Wieso wird sowohl bei endothermen und exothermen Vorgängen die Aktivierungsenergie benötigt? Was bedeutet der untere Pfeil mit „Reaktionsenthalpie“ beim Diagramm? Bei der oberen Darstellung zeigt dieser nach oben und bei der unteren Darstellung zeigt dieser nach unten. Wieso ist das so? Wieso steht manchmal die Enthalpie der Produkte Hp oben beim Diagramm und manchmal die Enthalpie der Ausgangsstoffe Ha?