Wie Funktioniert diese Reaktion?
Bei dieser Gleichung hab ich Schwierigkeiten, sie zu verstehen. Kann mir das jemand bitte erklären?
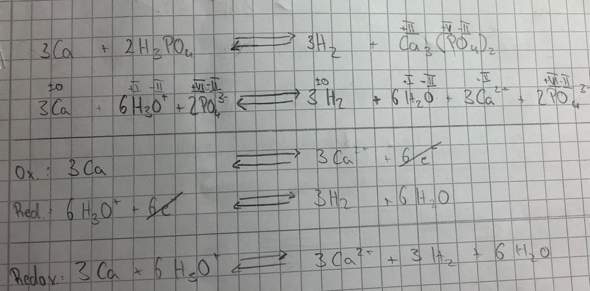
1 Antwort

Hi,
deine Verwirrung ist gut nachvollziehbar!
Es handelt sich hier um eine Redoxreaktion, die die Säure nicht als Katalysator, sondern als wirklichen Reaktionspartner beinhaltet. Die Redoxreaktion findet zwischen den Protonen und dem Calcium statt. Es reagieren Calcium und Phosphorsäure zu Wasserstoff und Calciumphosphat, was unausgeglichen erst einmal ergibt:
Ca + H3PO4 ⇌ H2 + Ca3(PO4)2.
Nun musst du die Reaktion auftrennen in zwei Teilreaktionen: Einmal die Reaktion, bei der Calcium seine Oxidationsstufe ändert, und die Reaktion, in der Wasserstoff die Oxidationszahl ändert. Da wir hier in wässriger Lösung arbeiten, kann man H3PO4 auch als 3 H+ und PO4(3-) schreiben. Ebenso kann man dann Calciumphosphat als Ca(2+) und 2 PO4(3-) schreiben. Wir erhalten also als Teilgleichungen:
Ca ⇌ Ca(2+)
3 H(+) + PO4(3-) ⇌ H2 + PO4(3-).
Das Phosphat-Ion in der zweiten Gleichung können wir streichen, da es auf beiden Seiten erscheint. Da du hier mit H(+)-Ionen arbeitest, musst du die Redox-Teilgleichungen mit H(+)-Ionen ausgleichen. Man kann auch, wie ihr das macht, H3O(+) schreiben. Dann muss man aber daran denken, dass auf der rechten Seite noch H2O ergänzt werden muss. Wir haben also:
Ca ⇌ Ca(2+)
2 H3O(+) ⇌ H2 + 2 H2O.
1. Oxidationszahlen bestimmenZunächst bestimmst du die Oxidationszahlen aller beteiligten Atome / Ionen in diesen Teilreaktionen, um zu ermitteln, wie viele Elektronen abgegeben werden und welche der Reaktionen die Oxidation, welche die Reduktion ist. Calcium hat eine Oxidationszahl von Null, da es ein Element ist. Das Calcium-Ion entspricht in seiner Oxidationszahl seiner Ionenladung, hat also eine Oxidationszahl von +2. Da sich die Oxidationszahl erhöht, handelt es sich um eine Oxidationsreaktion.
In der unteren Gleichung muss die Summe der Oxidationszahlen +1 ergeben, da die Oxidationszahl eines Ions der Summe der Oxidationszahlen der Atome entspricht. Das Sauerstoffatom hat (bis auf wenige Ausnahmen) die Oxidationszahl -2, Wasserstoff (bis auf Hydride) +1. Auf der rechten Seite hat Wasserstoff wieder Null (ist ja ein Element), Wasserstoff und Sauerstoff im Wassermolekül entsprechend wie links +1 und -2. Dort handelt es sich um eine Reduktion, da dich die Oxidationszahl von Wasserstoff verringert.
2. Anzahl der Elektronen bestimmenOx.: Ca ⇌ Ca(2+)
Red.: 2 H3O(+) ⇌ H2 + 2 H2O.
Nun bestimmst du die Anzahl der Elektronen, die abgegeben oder aufgenommen werden. Erinnere dich: Bei einer Oxidation werden Elektronen abgegeben, bei einer Reduktion Elektronen aufgenommen.
Calcium hat seine Oxidationszahl von 0 auf +2 geändert. Das heißt, es müssen zwei Elektronen abgegeben werden:
Ox.: Ca ⇌ Ca(2+) + 2 e(-).
Bei der unteren Reaktion nimmt die Oxidationszahl ab, wir haben also eine Aufnahme von einem Elektron je Wasserstoffatom. Somit werden also zwei Elektronen aufgenommen:
Red.: 2 H3O(+) + 2 e(-) ⇌ H2 + 2 H2O.
3. Phosphat berücksichtigenNun würde man denken, man sei fertig - passt doch alles! Allerdings stimmt das leider nicht, denn jetzt kommt das Phosphat ins Spiel: Wir wollen die Verbindung Ca3(PO4)2 haben. Allerdings stellst du bei Betrachtung beider Gleichungen fest, dass zwei H(+) mit zwei Calciumatomen reagieren. Allerdings haben wir bei H3PO4 drei H(+)-Ionen. Und am Ende brauchen wir auch drei Calciumionen. Das kleinste gemeinsame Vielfache von 2 und 3 ist 6. Das heißt, wir gleichen jetzt die Gleichungen so aus, dass die Anzahl der Elektronen oben und unten sechs entspricht:
Ox.: 3 Ca ⇌ 3 Ca(2+) + 6 e(-).
Red.: 6 H3O(+) + 6 e(-) + 6 PO4(3-) ⇌ 3 H2 + 6 H2O + 6 PO4(3-).
4. Gleichungen zusammenführen und "kürzen"Nun schreibst du alles, was links steht, in eine Gleichung, und alles, was rechts steht, auch:
3 Ca + 6 H3O(+) + 6 e(-) + 6 PO4(3-) ⇌ 3 Ca(2+) + 6 e(-) + 3 H2 + 6 H2O + 6 PO4(3-).
Alles, was auf beiden Seiten steht, kann rausgestrichen werden. Wir erhalten:
3 Ca + 6 H3O(+) + 6 PO4(3-) ⇌ 3 Ca(2+) + 3 H2 + 6 H2O + 6 PO4(3-).
Das Phosphat habe ich absichtlich stehengelassen, da wir eine in ihren Ladungen ausgeglichene Gleichung brauchen - mit dem Phosphat ist das etwas kompliziert: Eigentlich liegt es die ganze Zeit einfach in wässriger Lösung vor - vor der Reaktion, da wir eine wässrige Lösung der Säure haben, nach der Reaktion, da das Salz gelöst vorliegt. Die Reaktion findet nämlich eigentlich nur zwischen den H(+)-Ionen und Calcium statt. Wir packen nun an jeweils drei H(+) jeweils ein PO4(3-), um H3PO4 zu erhalten. Genauso viele PO4(3-) brauchen wir auf der rechten Seite und basteln sie mit Calcium zu Calciumphosphat. Aus den H3O(+) bleibt dann links Wasser übrig, das wir auch rausstreichen können:
3 Ca + 2 H3PO4 ⇌ 3 Ca(PO4)2 + 3 H2.
Die Gleichung ist nun ausgeglichen.
Ich hoffe ich konnte dir helfen, bei Fragen melde dich gern.
LG