Wer hat mehr Innere Energie?
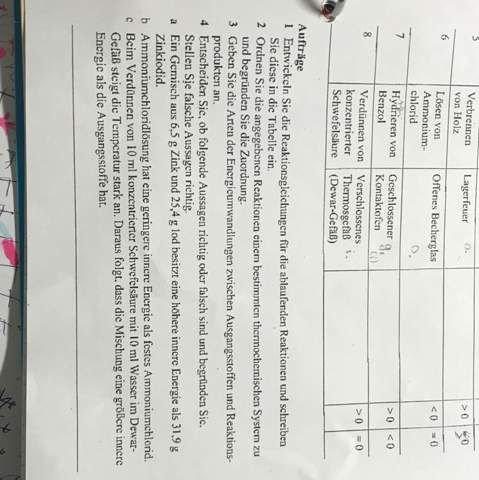
Also mir geht es nur um Aufgabe vier den Rest habe ich verstanden nur hier verzweifel ich wirklich, da ich nicht verstehe, woher man weiß, ob die Edukte oder Produkte mehr innere Energie haben. Vielen Dank schon mal:)
2 Antworten

Moin,
kommt darauf an, was der Aufgabensteller unter innerer Energie versteht.
Ich gehe jetzt einfach mal davon aus, dass damit einfach nur gemeint ist, ob ein Prozess freiweillig abläuft (weil die innere Energie der Edukte größer ist, so dass es zu exothermen Prozessen kommt). Wenn das die Basis ist, dann weiß man das, wenn man Erfahrung damit hat. Den Stoffbezeichnungen oder den reinen Reaktionsgleichungen (ohne die Angabe von Enthalpien) kann man das meist nicht ansehen. Insofern bist du entschuldigt, dass du keinen Zugang dazu gefunden hast.
Doch nun zur Aufgabe:
4a
Die Aussage stimmt. Die Elemente Zink und Iod haben zusammen in einem Gemisch eine höhere innere Energie als das Reaktionsprodukt Zinkiodid. Das kannst du daran sehen, dass man beide Elemente miteinander zur Reaktion bringen kann, die dann exotherm, also unter Freisetzung von Energie abläuft. Dass bei dieser Reaktion Energie freigesetzt wird, ist ein Zeichen dafür, dass die Edukte (die Elemente) mehr innere Energie aufweisen als das Produkt.
Ein weiterer Hinweis darauf ist, dass du das Produkt mit Hilfe einer erzwungenen Redoxreaktion (Elektrolyse) wieder in seine Bestandteile Zink und Iod zerlegen kannst, wenn du zum Beispiel Kohle-Elektroden in eine Lösung von Zinkiodid hineinhältst und dann (Gleich-)Strom fließen lässt. Da du in den Spaltungsprozess Energie hineinstecken musst (in Form von elektrischem Strom), haben die elementaren Ausgangsstoffe offenbar einen höheren inneren Energiegehalt als das Zinkiodid.
4b
Das stimmt. Ammoniumchlorid ist ein Salz, das in Wasser nur löslich ist, weil es dem Wasser Energie beim Lösungsprozess entzieht (darum wird es in sogenannten Kältemischungen verwendet). Das Wasser kühlt sich also spürbar ab.
Für das Lösen von Salzen in Wasser sind (vereinfacht gesagt) zunächst zwei Energiegrößen wichtig, nämlich die sogenannte Gitterenergie (also die Energie, die die Ionen des Salzes zusammenhält) und die sogenannte Solvatationsenergie (also die Energie, die frei wird, wenn Ionen im Wasser von einer Wasserhülle umgeben werden).
Ist die Solvatationsenergie größer als die Gitterenergie, dann löst sich das Salz "freiwillig" im Wasser, weil beim Lösungsprozess mehr Energie entsteht als für das Trennen der Ionen und damit die Überwindung der Gitterenergie verlangt.
Ist dagegen die Gitterenergie größer als die Solvatationsenergie, so löst sich das Salz nur im Wasser, wenn die fehlende Energie für das Aufbringen der Gitterenergie durch das Lösungsmittel aufgebracht wird. Dies geht nur, wenn die Gitterenergie nur wenig größer ist als die Solvatationsenergie. Ausschlaggebend für den Lösungsprozess in diesem Fall ist dann nämlich noch eine weitere Energie, die man Entropie nennt. Je beweglicher Teilchen eines Systems sind, desto größer ist seine Unordnung. Und die Entropie ist ein Maß für die Unordnung eines Systems. Da die Unordnung von frei beweglichen Ionen in einer Lösung größer ist als in einem Kristall (mit festgelegten Gitterplätzen), können Salze auch dann wasserlöslich sein, wenn ihre Gitterenergie eigentlich (ein bisschen) größer ist als die Solvatationsenergie.
Langer Rede kurzer Sinn: Festes Ammoniumchlorid hat einen höheren inneren Energiegehalt als gelöstes, weil seine Gitterenergie ein bisschen größer ist als die Solvatationsenergie.
Es ist dennoch wasserlöslich, weil durch das Lösen die Entropie steigt, so dass die zur Lösung eigentlich fehlende Energie von der Umgebung (also der Bewegung der Wasserteilchen) aufgebracht wird, so dass sich die Lösung abkühlt.
4c
Schwefelsäure ist eine ölige, stark hygroskopische (wasseranziehende) Flüssigkeit. Der Lösungsprozess von Säuren in Wasser ist allgemein ein exothermer Vorgang, das heißt, dabei wird Energie freigesetzt. Diese Energiefreisetzung kann so heftig sein, dass Temperaturen erreicht werden, bei denen das Wasser anfängt zu kochen. Deshalb gibt es die alte Chemiker-Weisheit:
»Erst das Wasser, dann die Säure - sonst passiert das Ungeheu're!«
Das spielt darauf an, dass man Säureverdünnungen stets so ansetzen soll, dass man zu einer (großen) Menge Wasser vorsichtig (kleinere Mengen) Säure hinzugeben soll, weil andernfalls gerade die freigesetzte Energie dazu führen kann, dass das Wasser verdampft und dabei Säuremoleküle mitreißt, so dass man von spritzender Säure eingenebelt wird...
Daraus kannst du also folgern, dass in den Ausgangsmaterialien (konzentrierte Säure und Wasser) mehr innere Energie steckt als in einer verdünnten Säurelösung. Demnach ist die in der Aufgabe getroffene Aussage falsch.
LG von der Waterkant.


Ich war mit ehrlich gesagt nicht ganz sicher, ob Innere Energie so definiert ist, dass chemische Bindungsenergie dazugehört. Deshalb habe ich nachgeschlagen.
Im Wikipedia-Artikel „Innere Energie“ steht der Satz
Sind chemische Reaktionen möglich, wird die innere Energie um die Energie der chemischen Bindungen der beteiligten Atomarten erweitert. Zur inneren Energie von Materie im Plasmazustand zählen auch die Ionisationsenergien der Moleküle und Atome.
Das deutet darauf hin, dass die innere Energie bei den Edukten größer sein müsste - wenn die Reaktion nicht in einem abgeschlossenen Gefäß stattgefunden hat und die Produkte abkühlen konnte.
Wenn man es sehr genau nimmt, bedeutet exakt gleiche Gesamtmasse auch gleiche innere Energie. Gleiche Stoffmenge und sehr geringfügig größere Gesamtmasse bedeutet eigentlich eine höhere Innere Energie, nach der berühmten Formel
E = mc²,
aber das fällt kaum ins Gewicht.