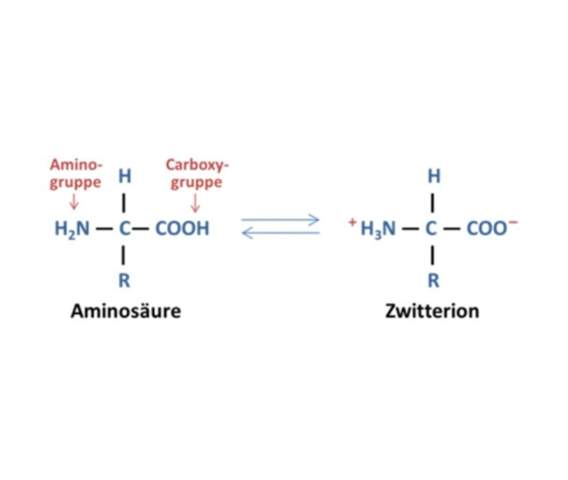
Warum liegt Glycin in Wasser als Zwitterion vor?
3 Antworten

Die schnelle Antwort ist: Weil die COOH-Gruppe sauer ist und die NH₂-Gruppe basisch. Also wandert ein H⁺ von der Säure zur Base, genauso wie wenn du CH₃COOH und NH₃ mischst und dann Acetat und Ammonium bekommst. Du kannst das also als eine Art intramolekulare Neutralisationsreaktion ansehen.
Quantitativ betrachtet: Stell Dir vor, die COOH-Gruppe spalet ein H⁺ ab (das kann sie, weil sie eine Säure). Wo geht das H⁺ hin? Es hat zwei Möglichkeiten:
- Es kann dorthin zurück, wo es hergekommen ist, also zur Carboxylat-Gruppe, denn die ist ja eine Base, genauer gesagt, de konjugierte Base zur COOH-Gruppe.
- Es kann zur NH₂-Gruppe, denn das ist auch eine Base
Von diesen beiden Möglichkeiten wird es sich die stärkere Base aussuchen, und daher kannst Du z.B. die Basenkonstanten vergleichen (wenn Du sie kennst). Normalerweise finde man in der Literatur aber die Säurekonstanten, und das ist dasselbe, nur von hinten gesehen. Die Säurekonstante für eine COOH-Gruppe liegt typischerweise so ca. bei pKₐ≈4, und für Ammoniak oder Aminogruppen um pKₐ≈9. Daher sind Carboxylgruppen stärkere Säuren als Ammoniumionen, und entsprechend Carboxylat-Ionen schwächere Basen als Aminogruppen.
Folglich geht das H⁺ zur Aminogruppe, und Du bekommst das Zwitterion.

In Lösung spaltet das Glycinmolekül verhältnismäßig leicht das H der Carbonsäure ab, das dann mit der NH2-Gruppe zum Zwitterion (Säure- und Baseion) reagiert.

Der pH-Wert des Wassers (es ist ein Amphoter) erlaubt zum einen eine Protonierung und eine Deprotonierung der Reste.