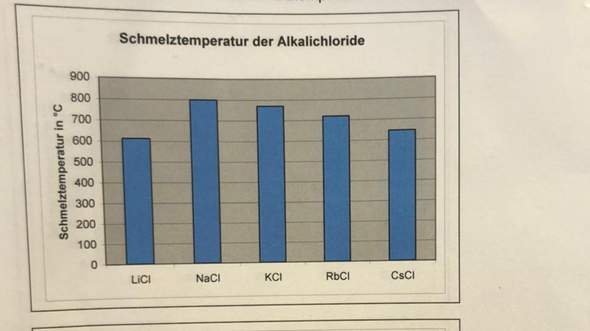
Warum hat NaCl eine höhere Schmelztemperatur als LiCl?
Mein Gedankengang ist folgendermaßen:
Li hat einen geringeren Ionenradius als Natrium. Beide Verbindungen sind einfach geladen. So hat LiCl doch laut dem coloumbschen Gesetz eine höhere Gitterenergie als NaCl, oder? Höhere Gitterenergie = Höhere Stabilität = Höherer Schmelzpunkt
Jedoch warum hat NaCl eine höhere Schmelztemperatur als LiCl
5 Antworten

Eigentlich sollte es höher schmelzen, wie du gesagt hast, wegen des geringeren Ionenradius und der höheren Anziehungkräfte.
Uneigentlich bestimmen aber die Ionenradien auch den Gittertyp und damit die Koordinationszahl. LiCl kristallisiert wie NaCl im NaCl-Gitter mit der Koordinationszahl 6. CsCl dagegen im CsCl-Gitter mit der Koordinationszahl 8.
Li, so vermute ich, liegt an der unteren Grenze der passenden pasenden Ionengröße für das NaCl-Gitter. Die größen Chloridionen berühren oder drücken einander, oder die Li-Ionen haben im Gitter etwas "Spiel", weil sie kleiner sind als ihre Lücken.
Eine Alternative wäre die Kristallisation in einem der Gitter mit Koordinatinszahl 4, also Zinkblende- oder Wurzitgitter. Das ist aber anscheinend noch ungünstiger.
Naja, und wenn das Gitter so oder so nicht recht passt, dann bricht es auch schneller zusammen, d.h. der Stoff schmilzt.


Ich müsste mich da wieder rein lesen könnte es sonst an der Masse liegen? Weil NaCl ist Natrium soweit ich weiß und Natrium hat glaube ich keine niedrigere Masse als LiCl.

Soweit ich weiß spielen jedoch nur die Ladungen und der Radius eine Rolle /:
Aber danke für den Kommentar, werde mal nachlesen

Vermutlich weil Lithiumchlorid mehr Kovalenz hat, bei HCl ist es noch niedriger.
Ohne Unterschrift.

Lithiumsalzen: Ihre Schmelzpunkte sind ungewöhnlich niedrig. Nach dem COULOMB-Gesetz müssten die Lithium-Salze eigentlich die höchsten Schmelztemperaturen haben, wegen der äußerst geringen Ionenabstände.
Nun sind aber die Lithium-Ionen derart klein, dass sie sozusagen nur noch eine Nebenrolle spielen. Die Hauptmasse des Kristallgitters besteht aus Halogenid-Ionen, die Lithium-Ionen halten sich quasi in den Lücken dieses Anionengitters auf. Dadurch kommen sich die negativen Anionen viel näher als z.B. bei den Natriumhalogeniden. Es werden jetzt Abstoßungskräfte wirksam, die den Anziehungskräften entgegengesetzt sind. Das wäre zumindest eine von mehreren möglichen Erklärungen für die niedrigeren Schmelztemperaturen der Lithiumhalogenide.
(Quelle: https://www.u-helmich.de/che/0809/04-Ionen/Ionenbindung-05.html 26.03.23)
Dies gilt also auch bei LiCl, deshalb hat NaCl einen höheren Schmelzpunkt.

Gitterenergie höher?