Redoxreaktion Ladungsausgleich?
Ich habe hier zwei Bilder von Redoxreaktionen. Beim ersten wird im Video gesagt, man muss einen Ladungsausgleich als auch einen Stoffausgleich durchführen, aber beim zweiten stellt man die gleichung ganz schlicht auf. Ich verstehe nicht, was da der Unterschied ist, bzw. kann man jede redoxreaktion mit dem Erweitern von H3O+ und H2O immer lösen?
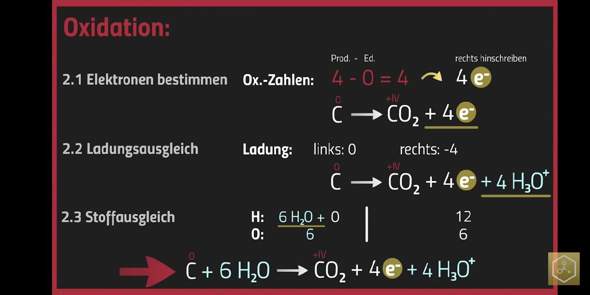
Hier wird viel rummerweitert

Hier wird einfach die Redoxreaktion ohne Erweitern ausgeführt.
Ich wäre dankbar für Aufklärung.
3 Antworten

Hallo Bjoern4Torateon
ich habe das Video gefunden, aus dem das Bild stammt. In dieser und in der zweiten Reaktion geht es um Reaktionen zwischen Feststoffen ohne Beteiligung von Wasser.
Die zweite Reaktion Fe + CuO → FeO + Cu ist daher richtig entwickelt und aufgestellt.
Bei der Reaktion 2 CuO + C → 2 Cu + CO₂ den Umweg über das Ausgleichen mit H₃O⁺ bzw. H₂O zu gehen, halte ich für falsch, denn Wasser ist definitiv nicht beteiligt.
Hier würden diese Gleichungen den Sachverhalt besser wiedergeben:
C → C⁴⁺ + 4 e⁻
2 Cu²⁺ + 4 e⁻ → 2 Cu
oder, wenn man den Sauerstoff mit hinzunimmt:
C + 2 O²⁻ → CO₂ + 4 e⁻
2 CuO + 4 e⁻ → 2 Cu + 2 O²⁻
Das Ausgleichen mit H₃O⁺, H₂O oder OH⁻ ist in wässrigen Lösungen ein allgemein gültiges Verfahren und in den meisten Fällen sogar notwendig. Bei Reaktionen ohne Beteiligung von Wasser ist sie falsch, auch wenn am Ende die richtige Endgleichung entsteht.
Ich vermute, man hat das notwendige Thema 'Ausgleichen' innerhalb der Redox-Gleichungen vorstellen wollen und dabei ein falsches Beispiel gewählt.
LG

Gerne geschehen :)
Ja genau. Wo kein Wasser ist, darf man auch keines ins Spiel bringen.

Irgendwie klappt dieses Vorgehen bei einer anderen Aufgabe nicht :(
Ich weiß nicht wo mein Fehler liegt. Ich poste es mal.




Gleichung 2: Die Oxoniumionen kommen aus dem "Nichts". Erstens fehlt eine Begründung dafür und insgesamt ist die Gleichung falsch, den H und O sind auf der Eduktseite nicht vorhanden.
Gleichung 3: Die Produktseite ist negativ geladen und die Eduktseite neutral. Das ist ebenfalls falsch.

Die ersten beiden Gleichungen dienen nur dazu, die dritte Gleichung zu entwickeln, wird aber erst im Video eindeutig.
Die dritte Gleichung ist - etwas schlecht zu erkennen - ausgeglichen durch 4 e⁻ und 4 H₃O⁺.

Danke Zwergbiber50 für den "Bau einer Brücke", denn in der 3. Gleichung ist auch ohne großen Willen alles gut zu erkennen.

s. Vach.
Die unteren Gleichungen (Fe/Cu) sind Ok.
Bei der oberen soll wohl die Oxidation von C durch O2 gemeint sein ("Verbrennung").
Die Gleichungen sind
a) unübersichtlich
b) umständlich. Das macht aber nicht viel, denn sie sind komplett
c) falsch.
Im Disney Channel läuft grade nichts, deshalb ausführlich:
C + O2 --> CO2. Das genügt; man kann noch hinzufügen, daß C formal 4 e- abgibt, die die beiden O´s aufnehmen.
Manche Pädagogen machen dabei den Ladungsausgleich mit H2O/H3O+. Das sähe so aus:
C + 2H2O --> CO2 + 4e- + 4H+ (Oxidation)
O2 + 4e- + 4H+ ---> 2H2O (Reduktion) bzw. "genau"
C + 6H2O ---> CO2 + 4 e- + 4H3O+
O2 + 4e- + 4H3O+ ---> 6 H2O
Man sieht, daß sich sowohl H3O+ wie H2O am Ende "kürzen".
Damit hat besagter "Pädagoge" wohl ausgleichen wollen, was aber gequirlter Kuhmist ist, denn weder Säure noch Wasser sind daran beteiligt.
Ein warnendes Beispiel für die Aufhebung des Leinenzwangs bei einer bestimmten Spezies von Lehrern.
Danke erstmal für die Antwort.
Das heißt, sobald eine Redoxreaktion z. B. beim Verbrennen stattfindet, muss ma diese lediglich dadurch aufstellen, dass man schaut, wo Elektronen zur Bildung von hier z. B. Kuoferoxid zu Kupfer benötigt werden, und dies dann auch so aufstellt?