Oxidationszahlen und Valenzstrichformel von FeCl3?

Das ist die Aufgabe. Nun versuche ich FeCl3 in Valenzstrichform zu schreiben. Hier bin ich aber leicht verwirrt.
Wenn Fe(+III) Ladung hat, muss demnach 3 Elektronen abgehen, Eisen hat aber 2 Elektronen auf der Außenschale. Somit hab ich mir gedacht, okay, es kann Bindungen geben, wo ein Stoff die Verbindung von sich aus herstellt. (d.h. 2 Elektronen vom selben Stoff, nicht wie im normalfall bei einer Elektronenpaarbindung, dass beide Stoffe x Elektronen stellen).
Lösung:
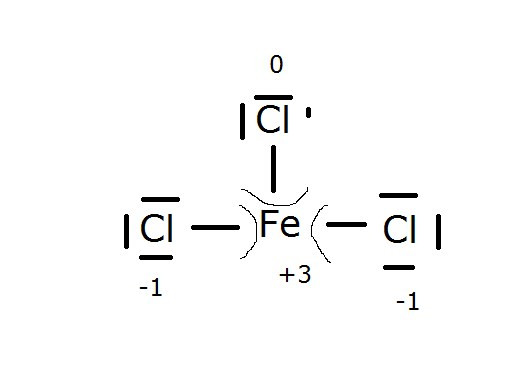
Dies würde nun zumindest die Fe +(III) erklären aus der Lösung die vorgegeben ist.
Nun die Frage, sind die Oxidationszahlen und die Valenzstrichformel richtig?
Wenn nicht, wie wäre sie denn richtig?
Lg
3 Antworten

Die Oxidationszahlen sind richtig, aber die Valenzstrichformel ist Käse.
In Chloriden ist die Oxidationszahl des Chlors −I, also muß das Eisen +III haben, damit in Summe die Gesamtladung, also Null, herauskommt.

Es gibt keine. Zumindest keine wie Du sie Dir vorstellst, weil das Material nicht aus FeCl₃-Molekülen besteht.
Stattdessen bildet FeCl₃ (dunkelgrün) einen Festkörper, in dem jedes Fe-Atom sechs Cl-Nachbarn hat. Im Detail ist die Struktur ziemlich komplex: Die Cl⁻-Ionen bilden eine hexagonale dichteste Kugelpackung, mit den Fe³⁺-Ionen in den oktaedrischen Lücken (nach jeder zweiten Schicht Chlorid sind ⅔ der Lücken besetzt). Damit biete ich Dir ziemlich exklusives Wissen, das vermutlich auch Dein Chemielehrer nicht zur Hand hätte.
Die meisten kennen FeCl₃ jedoch nicht als wasserfreien Festkörper, sonder als gelbbraunes Hexahydrat. Dabei hat jedes Fe³⁺-Kation zwei Cl⁻ und vier H₂O als Nachbarn (in einem [Fe(H₂O)₄Cl₂]⁺-Komplex, d⁵ high spin), das restliche Cl⁻ und die restlichen zwei H₂O alten sich irgendwo im Gitter auf
So genau wolltest Du es wahrscheinlich nicht wissen. Nimm aber das Folgende mit: Mit einem so simplen Konzept einer Lewis-Fomel kommt man beim FeCl₃ nicht weit.

Alles klar danke! Ich hab mir jetzt das Script nochmal angesehen.. da steht sowas wie "Halogene (F-, Cl-, ...): -1 " also hätte ich davon darauf schließen müssen. Aber selbst dann hätte es mich verwirrt, wenn Eisen eig nur 2 außenelektronen hat auf der letzten schale. Aber nungut, werde ich wohl mit klar kommen müssen.

Wie kommst Du auf „2 Außenelektronen“? Eisen hat eine Elektronenkonfiguration […]4s²3d⁵, also acht Elektronen die chemisch irgendetwas tun können. Aber das Zählen von Elektronen hilft bei den Übergangselementen viel weniger als in den Hauptgruppen. Und wenn doch, z.B. bei Carbonylen, dann ist die magische Zahl nicht acht sondern achtzehn, deshalb z.B. die Stöchiometrie Fe(CO)₅ — zehn Elektroen werden von den CO-Molekülen geliefert, macht 18 insgesamt.


Du solltest dich von der Vorstellung verabschieden, dass sich alle Stoffe und Stoffgruppen mit Lewisformeln darstellen lassen.
Das scheitert schon beim Sauerstoffmolekül und vielen Borverbindungen. Außerdem bei allen Stoffen, die nicht aus Molekülen/Molekülionen (oder vergleichbaren Einheiten wie Komplexen) aufgebaut sind, also Metallen, Salzen und vielen anderen.
https://de.wikipedia.org/wiki/Eisen(III)-chlorid schreibt:
Eisen(III)-chlorid ist eine vorwiegend kovalente Verbindung mit Schichtstruktur. Oberhalb des Sublimationspunkts liegt sie vor allem als gasförmiges Fe2Cl6 vor, das mit steigender Temperatur zunehmend zu FeCl3 dissoziiert.
Für das Schichtgitter ist eine Lewisformel sinnfrei. Schau dir mal die Bilder im Wikibeitrag an!
Für das Fe2Cl6 würde ich (analog Al2Cl6) folgende Formel vorschlagen, wobei die vier äußeren Cl-Atome in einer Ebene liegen, die beiden Brücken-Cl-Atome 90 ° dazu. Die äußeren Cl haben je 3 freie Elektronenpaare, die Brücken-Cl je 2.
Cl Cl Cl
\ / \ /
Fe Fe
/ \ / \
Cl Cl Cl
Beim FeCl3 einfach drei Einfachbindungen zum Fe zeichnen, und je 3 freie E.paare pro Cl. Dann ist formal kein Atom geladen. Fe(III) ist auch zu klein und zu hoch geladen, um wirklich ein Ion zu sein. Wenn du doch eine Ladung am Cl haben willst, dann hat ein Cl vier freie Elektronenpaare, ist also ein Chlorid, aber dann hast du keine kovlente Bindung mehr zum Fe.
Davon abgesehen stellt sich das Problem gar nicht, denn deine Formel und meine Ausführungen haben wasserfreies FeCl3 zum Thema. Sobald Wasser im Spiel ist, binden sich sowieso nur Wassermoleküle an Eisenionen. Das Wasser kriegst du auch nicht weg, beim Eindampfen entweicht HCl, kein Wasser.
Und zur Lösung der Aufgabe ist auch das unwichtig.

Eisen(III)chlorid hat zwar kovalente Anteile, aber es ist für dich einfacher, wenn du es als Metall-Nichtmetall-Verbindung, also als Salz betrachtest. Salze bestehen aus Ionen.
Chloridionen sind wie die anderen Halogenid-Ionen einfach negativ geladen.
Damit ist der Rest einfach.
Aber wie muss die Valenzstrichformel denn aussehn?