Müssen die Wertigkeit eines Atoms immer vollständig verbunden sein?
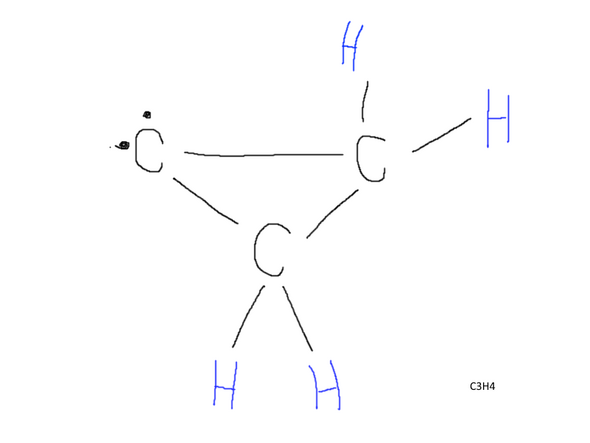
Wenn noch zwei H-Stoffe fehlen für Propan, würde dann dennoch die Bindung wie oben gezeigt stattfinden?
Oder ist es pflicht, dass alles im Molekül verbunden ist?
5 Antworten

Moin,
das Problem ist, dass ungepaarte (Valenz-)Elektronen energetisch so gut wie immer seehr ungünstig sind, das heißt, ein Teilchen mit einem ungepaarten Elektron ist ausgesprochen reaktionsfreudig. Es sucht sich Bindungspartner, wo immer es welche findet und "greift" diese an, um den Zustand der ungepaarten Elektronen aufzuheben.
Wenn du in einem Reaktionsraum Kohlenstoff und Wasserstoff in einem Verhältnis von C : H = 3 : 4 zusammen bringst und eine Reaktion auslöst, dann werden die beiden Elemente eine Verbindung eingehen.
Aber dabei wird kein Molekül entstehen, wie du es oben eingestellt hast. Denn bei deinem Molekül sind nicht nur zwei ungepaarte Elektronen vorhanden, sondern die drei Kohlenstoffe bilden auch noch einen Ring. Nun gibt es zwar sogenannte Cyclopropane, aber die drei Bindungen zwischen den Kohlenstoffatomen stehen unter einer großen Spannung. Solche Moleküle sind ihrerseits schon recht reaktionsfreudig, von den ungepaarten Elektronen mal ganz abgesehen.
Statt deiner Darstellung wird einfach Propin entstehen:
H–C(Dreifachbinding)C–CH3
denn hier sind nicht nur alle Valenzelektronen zu Paaren vereinigt, sondern die Bindungen in dieser linearen Molekülstruktur sind auch noch (nahezu) spannungsfrei.
Fazit:
Nein, das von dir gepostete Molekül wird es nicht geben, da es ungepaarte Elektronen sowie sehr gespannte Bindungsverhältnisse im cyclo-Ring hat, was beides energetisch sehr ungünstig ist. Stattdessen wird Propin entstehen.
LG von der Waterkant

Ja. Im Vakuum. Praktisch ist es aber so, dass sich immer etwas findet, das sich binden will. Also meistens Wasserstoff. Da muss auch Wasserstoff hin, weil es sonst kein Propan ist.
Teilweise verbinden sich bestehende umgebende Verbindungen neu, um diese Stelle einnehmen zu können.
MfG, Mil Gaspar

Das Molek"ul, das Du aufgeschrieben hast, heißt Cyclpropylcarben (glaube ich zumindest). Carbene sind Moleküle die einen zweibindigen Kohlenstoff enthalten. Der einfachste Vertreter dieser Substanzklasse ist CH₂, das Methylen.
Carbene sind so instabil, daß man sie nicht in Flaschen abfüllen kann, nicht einmal bei sehr tiefen Temperaturen. So ein Molekül könte sich aber als Zwischenprodukt in einer Reaktion bilden, z.B. ungefähr so
CH₃–CHCl₂ + Zn ⟶ ZnCl₂ + CH₃–CH
(Nagle mich aber bitte nicht fest, ob das wirklich so geht, ich bin kein Organiker und habe nur geschätzt). Das gebildete Carben (Methylmethylen oder Ethylen) würde dann sofort weiterreagieren, z.B. könnten zwei davon zu 2-Buten dimerisieren.
Dein Carben enthält noch zusätzlich einen Dreiring, der für sich allein schon ziemlich exotisch ist. Die Chance, daß man es jemals beobachten kann, schätze ich daher als eher gering ein.
A word for the wise: Carbene enthalten zwei freie Elektronen und können daher als Singulett (Spins gepaart) oder Triplett (Spins ungepaart) auftreten. Für die meisten Carbene ist der Triplett die stabilere Variante, aber dazu gibt es Ausnahmen, z.B. CF₂ hat einen Singulett-Grundzustand, und auch Cyclopropylmethylen C₃H₅–CH. Die homologen Silylene SiH₂ etc bevorzugen den Singulett.
Um Deine Frage weiter zu fassen: Es gibt auch Verbindungen mit dreibindigen C-Atomen, die sogenannten Alkyl-Radikale (CH₃ Methyl etc). Auch die sind meist sehr instabil, aber es gibt ein paar, die zumindest in Lösung haltbar sind, z.B. Triphenylmethyl (C₆H₅)₃C·


Cyclopropylen sähe ich als Cyclopropen an. Englisch wärs, glaub ich, wohl Cyclopropanylidene.

- Freie Elektronen oder Elektronenpaare können durchaus auftreten, aber abhängig vom Element sind Verbindungen mehr oder weniger stabil.
- Kohlenstoffatome mit Elektronensextrett sind extrem instabil und reaktiv und treten nur selten auf; es gibt sie also "theoretisch", aber in er Praxis haben sie meistens nur extrem kurze Lebensdauern und reagieren dann ab.
- Im Falle von Kohlenstoff nennt man solche Verbindungen "Carbene". Siehe hier: https://de.wikipedia.org/wiki/Carbene

Die beiden freien Valenzen müssen noch besetzt werden, ob mit einem Sauerstoff oder zwei Wasserstoff oder sonst was ist egal. Allerdings bilden die drei C keine Propan-, sondern eine Cyclopropanstruktur.

Muss es immer binnen weniger Sekunden komplett Verbunden sein in der Natur?
Wieso kann ein CH2 Molekül nicht ein bisschen herum fliegen bis er auch noch die restlichen 2 H Atome gefunden hat?

Es geht nicht so sehr um die Zeit an sich, sondern um die Zeit, nach der es mit etwas anderen zusammenprallt.
Außer im Hochvakuum geht das sehr sehr schnell.
Je instabiler ein Molekül, desto weniger wählerisch ist es bei der Wahl seiner Reaktionspartner.

Wie lange solche Strukturen stabil sind hängt z.B. von deren innerer Stabilität, der Konzentration und der Temperatur ab. Bei der von dir gezeichneten Struktur tippe ich darauf, daß ein Elektron und ein Wasserstoff ihre Plätze tauschen und anschließend die beiden benachbarten Elektronen eine Doppelbindung ausbilden, so daß Cyclopropen entsteht.

Cycloethylcarben? Carben ist CH₂, abgeleitet von systematisch Carban für bevorzugt Methan. Oder Cyclotricarben?