Molekülorbitaltheorie - Bindungs-Energiediagramm Methan
Hey
zurzeit gucke ich mir die Molekülorbitaltheorie etwas näher an. Ich finde diese Erkenntnisse alle sehr interessant und ich probiere so für mich herum um es besser zu verstehen. Ich verstehe das noch nicht so wirklich mit dem delokalisierten Elektronen aber darum soll es jetzt nicht gehen.
Wie zeichne ich ein Bindungs-Energiediagramm (So nenn ich es einfach mal...es stand nirgengswo ein Name dafür) für Methan Heißt das einfach nur Molekülorbital-Energiediagramm ?
Ich weiß wie ich das für Heteroatome zeichne und wie ich die Elektronenverteile (Sigma und Pi Bindungen) aber irgendwie weiß ich nicht wie ich das machen soll wenn ich 1x Kohlenstoff habe 1s2 2s2 2p2 und 4x Wasserstoff 1s1 habe.
Ich hoffe ihr könnt mir helfen :)
Hier ist noch ein Bild von dem Diagramm das ich meine :D
Liebe Grüße Serienjunkie96
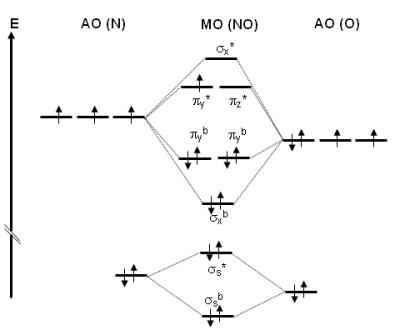
2 Antworten

Diese Diagramme bezeichnet man tatsächlich als Molekülorbitaldiagramm (oder kurz MO-Diagramm). Sie geben aufschluss über die Elektronenverteilung im Molekül, da gibt es eben energetisch günstige Zustände (bindende Orbitale) und energetisch ungünstige Zustände (antibindende Orbitale). Je nachdem wie diese besetzt sind kann man auf die Bindungsordnung schließen (Summe e- in bindenden - Summe e- in antibindenden Orbitalen durch).
Methan:
Da gibt es grundsätzlich zwei Möglichkeiten dieses MO-Diagramm anzusetzen
-
streng nach MO
-
nach dem Hybridisierungsmodell
Beide Varianten sind relativ ähnlich, nur beim Hybridisierungsmodell gehst du davon aus, dass im Kohlenstoff eine sp3-Hybridisierung der Orbitale vorliegt. Bedeutet: statt eine 2s und drei 2p - Orbitalen hast du vier energetisch gleichwertige sp3-Orbitale die energetisch zwischen den beiden liegen. Du kannst die Orbitale entweder einzeln (als Strich) hinschreiben oder einfach ein 4x vor ein Orbital schreiben. Jedes sp3-Orbital ist mit einem e- besetzt.
Das weitere Vorgehen ist identisch, nur gehst du einmal eben von vier gleichen Orbitalen bzw. streng nach MO von eine 2s und drei 2p-Orbitalen aus.
Für den Wasserstoff gilt das gleiche wie für die sp3-Orbitale, du kannst entweder jedes Orbital extra hinmalen oder einfach eine 4x vor ein 1s Orbital setzen.
Jetzt kommt es zur Orbital Aufspaltung:
Bei den den sp3-Orbitalen erhälst du 4x ein bindendes und 4x ein antibindendes Orbital. Die besetzt du einfach mit den zur Verfügung stehenden Elektronen gemäß der Hund'schen Regel und dem Pauli-Prinzip (nicht vergessen, wenn du ein 4x davor stehen hast besetzt du das Orbital auch 4x bzw. musst du 4x Elektronen aus den Ausgansorbitalen einbringen!!). Fertig.
Streng nach MO-Theorie spaltet sich einmal das 2s-Orbital des Kohlenstoffs in ein bindendes (ganz unten) und ein antibindendes (ganz oben) Orbital - das gibt die energetisch günstigste Situation (alle s-Orbitale d. H-Atome mit gleichem Vorzeichen wie s-Orbital d. Kohlenstoffs) und die energetisch ungüstigste Situationn (alle s-Orbitale d. H-Atome mit umgekehrtem Vorzeichen wie s-Orbital d. Kohlenstoffs) wieder. Das p-Orbital erzeugt drei gleichwertige (energetische etwas höhere) bindende Orbitale (eine Knotenebene die die Orbital-Lappen mit gleichem Vorzeichen voneinander trennt) und drei gleichwertig antibindende Orbitale (in denen z.B. das negative VZ des p-Orbitals d. Kohlenstoffs auf zwei positive VZ der Wasserstoffs trifft). Die so erzeugten Orbitale werden nach der Hund'schen Regel und dem Pauli-Prinzip aufgefüllt. Fertig.
In Klammer hab ich zumindest versucht dir ein bisschen zu veranschaulichen, wie diese "Molekülorbitale" aussehen. Sie geben quasi das aufeinandertreffen der Orbitale der Ausgangsatome an. Dass Orbitallappen zwei verschiedene Vorzeichen haben sollte dir bekannt sein und dass nur Orbitallappen gleichen Vorzeichens eine Bindung eingehen auch. Je nachdem welche Orbitallappen nun aufeinander treffen gibt es eben einen energetisch günstigen oder ungünstigen Zustand, nichts anderes wird hier dargestellt. Ich hoffe das verwirrt dich jetzt nicht zu sehr ;-)
Welche Methode ist nun besser:
Stärke Hybridisierungs-Modell: Geometrie wird korrekt vorher gesagt!
Stärke streng nach MO: Bindungsverhältnisse werden richtig vorher gesagt!
Nach dem Hybridisierungs-Modell hast du vier gleichwertige bindende Orbitale. Tatsächlich stellt man aber zwei verschiedene bindende Molekülorbitale fest. Durch Aufspaltung des s- und der p-Orbitale des Kohlenstoffs erhält man streng nach MO also die richtigen Bindungsverhältnisse, aber die Geometrie wird nicht berücksichtigt.
So und jetzt erstmal alles verdauen ;-)

ich würde dir empfehlen, das Malen von MO-Diagrammen erstmal mit nem 2-atomigen Stoff auszuprobieren... z.B. O2 ... da wirst du dann sehen, dass es sich eigentlich um ein Diradikal handelt...
Mit 4 Liganden muss man sowas selbst im Studium eigentlich selten malen... außerdem greift man grade beim Kohlenstoff eigentlich eher zum Hybridisierungsmodell zurück, so wie Käselocher das beschrieben hat...
Übrigens Top-Antwort! :D

Ja also mit zwei Atomen kann ich das und habe das auch verstanden mit den sigma, sigma-stern, pi und pi-stern orbitalen.
Aber selbst wenn man das im Studium selten malen muss, würde es mich doch interessieren. Bis ich Chemie studiere, dauert es noch ca. 1 1/2 Jahre und das ist mir definitiv zu lange.
Aber ich werde mir dann gleich mal das Hybridisierungsmodell ansehen. Vielleicht verstehe ich das ja dann besser.
Okay wenn man beim Kohlenstoff auf das Hybridisierungsmodell zurückgreift..wie sieht es dann mit Ammoniak aus? NH3 :D
Vielen Dank

Also auch die Herstellung von Biodiesel ist spannend ;-)
Die MO-Theorie ist schon nicht ganz einfach, daher Respekt wenn du dir das autodidaktisch aneignest. Die nächst komplexere Stufe an Mo-Diagrammen wäre dann wohl das Ethen :-P
Ich kann hier leider kein Bild anfügen, aber ich schick dir mal eine Seite aus meinem OC1-Skript von der Uni, da ist das ganz schön nebeneinander einmal als Hybridmodell und einmal streng nach MO ;-)

Hehe das nenn ich mal Ehrgeiz ;-)
Aber du stellst die richtigen Fragen, bei Ammoniak hast du auch eine sp3-Hybridisierung.
Hybridisierung bedeutet nichts weiter, dass du verschieden energetische Orbitale miteinander mischt und je nach Anzahl der Orbitale die du zum mischen nimmst genau so viele energetisch gleiche Hybridorbitale erhälst. Dadurch erhälst du die geometrischen Strukturen (Tetraeder, trigonal pyramidal, planar trigonal, etc.) je nachdem welche Orbitale gemischt werden.
Ammoniak hat eine tetraedrische Struktur wie Ethan, also muss die gleiche Hybridisierung vorliegen ;-)
Du hast meistens bei Verbindungen mit mehreren Liganden eine Hybridisierung vorliegen, weil nach der Orbital-Struktur im Grundzustand die Achsen der p-Orbitale senkrecht aufeinander stehen und das s-Orbital kleiner ist die p-Orbitale. Ohne Hybridisierungsmodell kann man sich also bei dieser Geometrie nur schwer vorstellen, dass z.B. tetraedrische Moleküle entstehen!
Wichtig ist aber auch noch, dass das Hybridisierungsmodell nur ein Modell ist und nicht die Wirklichkeit wieder gibt. Es hilft uns Geometrien zu verstehen und zu vereinfachen, aber die Realität ist leider nicht so trivial! Die Schwächen des Hybridisierungs-Modells habe ich bei meiner Antwort bereits angesprochen: die Bindungsverhältnisse werden auf diese Weise nicht korrekt wiedergegeben!

Ja also ich finde das auch sehr interessant :) Ich liebe Chemie in der Schule..besonders wenn wir Experimentieren (Biodiesel aus Raps, Titration etc..)
Ja, in der Schule lernen wir sowas nicht. ca. 95% meiner Mitschüler in meinem Chemie-Kurs hassen das Fach und haben das nur weil sie es mussten. Ich liebe deses Fach und gehe da richtig auf. Hab da auch 14-15 Punkte bekommen aufm Zeugnis.
Ja das ist sehr nett von dir. Vielleicht verstehe ich das dann noch besser :) Was ich aber ganz cool fande war das mit der Bindungsordnung. Ich wusste gar nicht das man das so herausfinden kann welche Bindungen bspw. N2 oder H2 haben und das man da auch sieht das es He2 nicht gibt.
so etwas finde ich ziemlich interessant und sehr schade das soetwas in der Schule nicht vermittelt wird. :D

Hier noch ein Link mit entsprechenden Bildern als Ergänzung zu Kaeselochers Antwort: (Text Englisch) http://www.meta-synthesis.com/webbook/40_polyatomics/polyatomics.html
Vielen dank für diese sehr ausführliche Antwort. Ich muss mir mal Hybridisierungen angucken um das besser nachvollziehen zu können aber mit deiner Erklärung habe ich das schon viel besser verstanden :)
Kannst du das mal zeichnen? damit ich das mit deinem Text besser verstehen kann? weil das ist doch leicht kompliziert für einen der sich das alles selber beibringt. In der Schule sind wir gerade dabei Biodiesel aus Raps herzustellen und mich interessiert die Molekülorbitaltheorie auch sehr aber die wird in der Schule nicht erklärt :)