Kann mir jemand die Lewis Formel zu Phosphorsäure erklären (Bild ist beigefügt)?
Ich suche eine gute Erklärung für die Lewisformel der Phosphorsäure, ich bin nicht die hellste in Chemie und brauche das für einen Vortrag! Danke im Vorraus :D
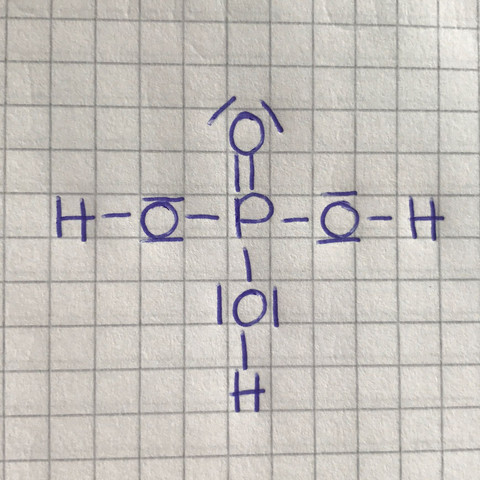
2 Antworten

Moin,
ich weiß, ich weiß... die Lewisformel für Phosphorsäure wird häufig so dargestellt wie auch du sie gepostet hast. Aber es ist deshalb nicht unbedingt richtig.
Atome gehen Verbindungen miteinander ein, weil sie in ihren Hüllen eine Elektronenkonfiguration anstreben, wie sie Edelgasatome von Natur aus haben (deshalb bezeichnet man diese energetisch besonders günstige und stabile Anordnung auch als "Edelgaskonfiguration").
Wasserstoffatome erlangen eine Edelgaskonfiguration, wenn sie zwei Elektronen für sich beanspruchen können.
Vereinfacht gesagt erlangen alle anderen Atome eine Edelgaskonfiguration, wenn sie acht Elektronen in ihrer Außenschale erlangen.
In Atombindungen gehören die bindenden Elektronenpaare stets beiden Bindungspartnern gemeinsam, das heißt, jeder Bindungspartner kann beide Bindungselektronen als zu sich gehörig betrachten...
So, und nun betrachten wir unter diesen Voraussetzungen deine Darstellung noch einmal genauer:
IOI
_ II _
H–O–P–O–H
¯ I ¯
IOI
I
H
Alle Wasserstoffatome "sind zufrieden", denn sie können alle zwei Elektronen für sich reklamieren (wie gesagt, die bindenden Elektronenpaare zwischen den Wasserstoff- und den Sauerstoffatomen gehören gleichzeitig zu den jeweiligen Bindungspartnern!).
Auch alle Sauerstoffatome können "zufrieden" sein, weil sie alle die begehrten acht Elektronen ergattern konnten.
Aber wie steht's beim Phosphor? - Tja, der ist quasi "überversorgt"! Er braucht für eine Edelgaskonfiguration eigentlich nur acht Elektronen in seiner Außenschale, hat aber laut Formeldarstellung zehn (je zwei durch die drei Bindungen zu den OH-Gruppen macht sechs Elektronen plus vier durch die Doppelbindung zum Sauerstoff...).
Das erklärt man gerne so, dass Phosphor bereits so große Atome hat, dass sie in ihrer Außenschale Unterbereiche haben, in die (zusätzliche) Elektronen untergebracht werden können. Aber irgendwie ist das eine unbefriedigende Erklärung, denn erstens sind die Phosphoratome gar nicht mal so groß und vor allem sind die angesprochenen Unterniveaus energetisch doch ziemlich ungünstig, so dass es sehr fraglich erscheint, dass sie zur Unterbringung von ("überzähligen") Elektronen herangezogen werden. Das erkennst du schon daran, dass zum Beispiel Elemente wie Kalium oder Calcium bei der Besetzung ihrer Atomhüllen mit Elektronen "lieber eine neue Schale anfangen", als die Außenelektronen in die tatsächlich vorhanden Unterräume der dritten Schale zu geben!
Also suchen wir nach einer besseren Deutung (und gelangen dabei zu einer etwas anderen Darstellung:
_
IOI^–
_ I _
H–O–P^+–O–H
¯ I ¯
IOI
I
H
In dieser Darstellungen soll der oben stehende Sauerstoff eine negative Formalladung besitzen, während der Phosphor eine positive Formalladung hat. (Eine Formalladung kreist man eigentlich ein, aber das kann ich hier nicht darstellen.)
Die Formalladungen kommen dadurch zustande, dass hier der obere Sauerstoff drei freie Elektronenpaare um sich herum hat sowie ein bindendes Elektronenpaar zum Phosphoratom. Das macht zusammen acht Elektronen und gehorcht somit der Forderung, dass alle Atome eine Edelgaskonfiguration in ihrer Außenschale haben möchten. Aber wenn man in dieser Situation das bindende Elektronenpaar gerecht in der Mitte teilen und jedem Bindungspartner eins der Elektronen zusprechen würde, dann hätte der obere Sauerstoff plötzlich sieben Außenelektronen (sechs aus den drei freien Elektronenpaaren plus ein Elektron aus dem bindenden Elektronenpaar). Somit hat dieses Sauerstoffatom formal ein Elektron mehr, als im atomaren (ungebundenen) Zustand. Ein Elektron formal mehr bedeutet formal eine negative Ladung mehr; darum die (umkreiste) Formalladung "–".
Beim Phosphoratom wäre das genau umgekehrt. Wenn man sich alle bindenden Elektronenpaare zu den Sauerstoffatomen gerecht zwischen den Bindungspartnern aufgeteilt vorstellt und dann nachzählt, hätte Phosphor nur noch vier Elektronen. Das wäre ein Elektron weniger, als er es als Atom eigentlich in seiner Außenschale haben würde. Ein Elektron formal weniger heißt eine negative Ladung formal weniger, also eine positive Formalladung (ein "+" in einem Kreis oben am Phosphorsymbol).
Das gesamte Molekül bleibt trotz der Formalladungen ungeladen, weil sich die negative Formalladung am oberen Sauerstoffatom und die positive Formalladung am Phosphoratom in ihrer Wirkung gegenseitig aufheben.
UND in dieser (besseren) Darstellung würden alle Atome der Forderung genügen, in ihren Außenschalen eine Edelgas-Elektronenkonfiguration zu haben...
Also: Die von dir gebrachte Darstellung findet man oft. Aber sie ist unbefriedigend, weil darin das Phosphoratom mit Elektronen überversorgt ist und es somit viel schwerer fällt, das mit dem Streben nach einer Edelgaskonfiguration in Einklang zu bringen.
Die andere Darstellung ist in dieser Hinsicht viel besser, auch wenn es hier nötig ist, zwei Formalladungen einzuführen...
Ich hoffe, du hast das alles verstanden. Wenn du noch Fragen hast, stell sie ruhig...
LG von der Waterkant.

Vielen Dank für die Mühe, die du dir gemacht hast! Wirklich sehr gut erklärt und so das sogar ich es verstanden habe :)

https://youtube.com/watch?v=Art2FUdp55A
Fang mal damit an. Deren Videos sind oft zum haareraufen unvollständig, aber man kann sich wegen der angenehmen kürze mehrer Videos zu einem Themenbereich anschauen und bekommt dann ganz gut mit worum es geht.
Und auch noch unterhaltsam :).