Ist das ein F Orbital?
4 Antworten

Moin,
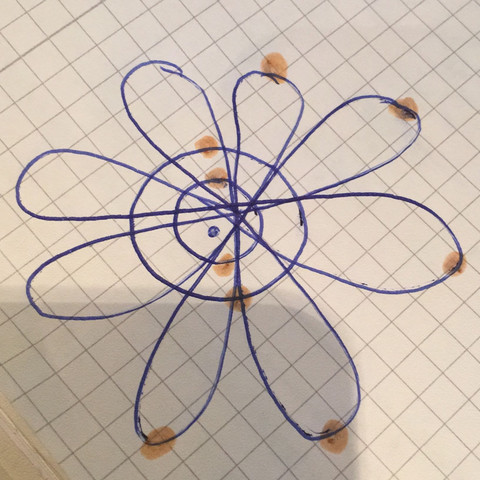
das ist etwas gaaanz Merkwürdiges. Du hast im Bild 9 Elektronen verteilt (sofern die gelb-braunen Kreise Elektronen sein sollen). Neun Elektronen hat ein Fluoratom. 2 x 2 der Elektronen befinden sich dabei in den innen liegenden Kreisen. Damit könnten s-Orbitale gemeint sein, die jeweils zwei Elektronen beinhalten, also 1s^2 und 2s^2.
Aber nun kommt's. Im Grundzustand eines Fluor-Atoms würden jetzt die hantelförmigen 2p-Orbitale besetzt werden, aber davon gibt es nur drei und nicht vier wie in deinem Bild. Unter den f-Orbitalen gäbe es zwar tatsächlich Formen, die zweimal vier blasenartige Orbitale hätten, aber die wären erst bei den Atomen von Elementen ab der 5. Periode zu besetzen. Fluor gehört aber zu den Elementen der 2. Periode!
Natürlich könntest du einwenden, dass es sich nicht um ein Atom im Grundzustand handeln muss, sondern um eines im angeregten Zustand. Und warum sollen die fünf Elektronen aus den 2p-Orbitalen dann nicht in den besagten 5f-Orbitalen landen? Aber sehr viel wahrscheinlicher erscheint mir, dass du dich beim Malen vertan hast und nur drei Doppelhanteln zeichnen solltest, in die dann die fünf noch nicht verteilten Elektronen des Fluors so hineingehören, dass zwei der drei Doppelhanteln mit jeweils zwei Elektronen besetzt werden und eine Doppelhantel nur über ein Elektron verfügt.
Wenn du zum besseren Verständnis Bilder von Orbitalen sehen möchtest, guckst du zum Beispiel hier:
LG von der Waterkant.

Vielen lieben Dank, ich habe meinen Fehler jetzt verstanden :D

Vermutlich handelt es sich um die 1s, 2s und 2p-Orbitale.
m.f.g.
anwesende

Du hast recht, aber ich vermute, es handelt sich um Fluor:
Doppelt besetztes 1s, ebenso 2s und 5 Elektronen in den p-Orbitalen. De Fehler des Zeichners liegt darin, daß er die Oktett-regel (wie früher) mit 8 Elektronen im äußeren "Ring" um den Kern malen wollte und dabei die 2s Elektronen übersehen hat. Dadurch hat er 4 Stück p-Orbital-hanteln gemalt.
Anyway. Wie die Orbitale aussehen, kann man im Link von DeDem sehen.
m.f.G.
anwesende

Nur ist bei den "p-Orbitalen" einiges falsch.
Sie sind nicht nur eines zuviel, sondern alle auch noch doppelt so viele.

Sieht eher wie d aus (5 Orbitale f hat sieben)...

Es ist ein f-Orbital, mit kleinen "f".
Also google noch mal danach.
Würde ich vom Titel des Bildes her ("Orbitalmodell von Fluor?") auch vermuten.
p-Orbitale bilden aber 3 Doppelhanteln (die paarweise senkrecht aufeinander stehen).