Chemie-warum kein Dipol?
Hier liegt ja kein Dipol vor, weil die Ladungsschwerpunkte zusammenfallen.
Aber woher weiß man, wo man diese gestrichelte Linie ziehen muss, um zu beurteilen, dass die Ladungsschwerpunkte zusammenfallen und somit kein Dipol vorliegt?
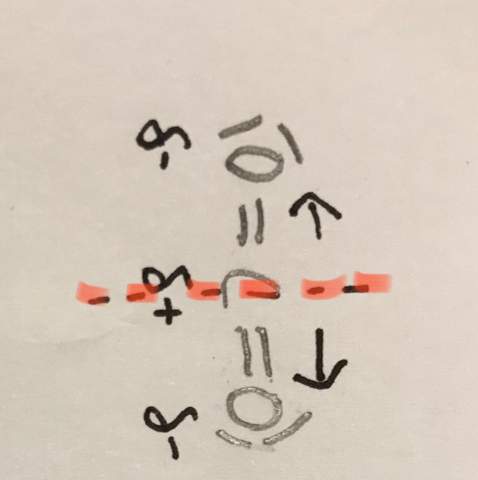
danke!
2 Antworten

Kurz: Symmetrie zerstört Dipolmomente. Symmetrisch aufgebaute Moleküle wie CO2 oder BF3 haben niemals ein permanentes Dipolmoment. Achte bei der Anwendung der Regel aber darauf, dass du keine Elektronenpaare unterschlägst. Außerdem können, abhängig vom Solvat (schwache) temporäre Dipolmomente induziert werden.

HF ist nicht symmetrisch aufgebaut, auf einer Seite hast du partiell positiven Wasserstoff, auf der anderen partiell negatives Fluor. Wäre das Molekül H-F.H und linear, dann wäre es symmetrisch. Die gestrichelte Achse ist die Symmetrieachse, wie du sehen kannst sind links und rechts dieser Achse die gleichen Bindungen mit den gleichen Atomen, daher ist CO2 symmetrisch.

ah, okay danke, also immer auf die Symmetrie verlassen?
und das mit dem Zusammenfallen der Ladeschwerpunkte ist nicht wirklich das Kriterium?

Das ist dasselbe. Hinreichend hohe Symmetrie erzwingt das Zusammenfallen der Ladungsschwerpunkte am Massenschwerpunkt des Moleküls.
Es ist ein bißchen trickreich, was „hinreichend“ ist. Grob gesagt: Alles größer als Pyramidensymmetrie hat kein Dipolmoment.

und wieso eigentlich reicht die Differenz der Elektronegativitätswerte nicht aus, um zu bestimmen, ob polar oder unpolar? Wieso braucht man die Molekülgeometrie?

Das demonstriert das CO₂ sehr schön: Jede einzelne C=O-Bindung ist für sich polar, aber das CO₂-Molekül ist es nicht, weil sich die beiden Bindungsdipolmomente gegenseitig aufheben. Daß sie sich genau aufheben, wird von der Symmetrie erzwungen (es liegt ja Zylindersymmetrie vor).

okay, also die Differenz der Elektronegativitätswerte bezieht sich nur auf EINE Bindung, warum aber haut das nicht bei H - F hin, dann würde es heißen, es sei eine ionische Bindung, aber es ist ja in Wahrheit eine polare Atombindung?
würde mich um eine weitere hilfreiche Antwort sehr freuen!!!

Die EN-Differenz ist nur ein Hilfsmittel und nicht die ultima ratio. Ja, generell gilt als Faustregel, dass alle Verbindungen mit einer ΔEN > 1,7 ionisch sind, aber das ist eben nur eine Faustregel. Eisen(III)chlorid zum Beispiel hat eine ΔEN < 1,7 ist aber dennoch ein Salz und alle Bindungen im Ozon haben gar keine ΔEN, dennoch ist es ein schwacher permanenter Dipol.

also ist die Molekülgeometrie da eine deutlich sichere Variante bei der Bestimmung der Polaritäten von Molekülen?
oder??

Warum diese Faustregel explizit beim HF nicht hinhaut weiß ich nicht, aber ich vermute, dass es an den ausgeprägten Wasserstoffbrückenbindungen zwischen den HF-Molekülen liegt, die die negative Partialladung des Fluors stabilisieren.


und wieso eigentlich reicht die Differenz der Elektronegativitätswerte nicht aus, um zu bestimmen, ob polar oder unpolar? Wieso braucht man die Molekülgeometrie?
Die Elektronegativitätsdifferenz (mit allen von Allesisi98 aufgelisteten und noch weiteren Problemen) sagt Dir etwas über die Polarität der einzelnen Bindungen. Die Symmetrie sagt Dir, ob die Summe der einzelnen Bindungsdipolmomente zwangsläufig Null sein muß oder nicht.
Propan hat die Symmetrie eines gleichschenkeligen Dreiecks. Das ist eine Form von Pyramidensymmetrie und deshalb für das Dipolmoment OK. Aber die Bindungsdipolmomente für die C–H- und C–C-Bindungen sind winzig klein, und deren Summe ist es auch ⇒ das Molekül ist praktisch unpolar (eine Feldmaus ist leise, und ein Chor davon füllt auch keine Konzerthalle). Die Ladungstrennung ist von vorneherein nur sehr gering, und die Schwerpunkte liegen auch noch nahe aneinander.
SiCl₄ hat vier sehr polare Si–Cl-Bindungen (es ist ein Molekül, kein Salz oder polymerer Festkörper). Aber die Atomanordnung ist tetraedrisch; das ist eine sehr hohe Symmetrie, die kein Dipolmoment erlaubt (nicht einmal ein Quadrupolmoment), oder anders gesagt, die vier Bindungsmomente summieren sich zu Null, oder nochmals anders gesagt, der Schwerpunkt der δ⁻ (der Mittelpunkt zwischen den vier Cl-Atomen) fällt genau mit dem δ⁺ (dem Si-Atom) zusammen.

danke!
Ist diese Frage vielleicht auch noch lösbar?
Dipol-Moleküle sind elektrisch neutral geladen.
Wie können sie neutral sein, wenn man z.B. hier die Ladungen (seine Partialladungen) von einem Wasser-Molekül anguckt:
+1 + 1 + (-1) = 1 (nicht 0)
?
danke :)

Der Sauerstoff im Wasser zieht 2 Elektronen zu sich: -2. Die Wasserstoffe "verlieren" jeweils 1 Elektron, 2*(+1) = +2
+2 + (-2) = 0


Die Rechnung ist Käse — die δ⁺-Ladungsmenge an einem H ist ja nicht gleich dem δ⁻ am O, sondern nur halb so groß.

und wie erklärt man dann, wenn es aufgrund der Partialladungen nicht geht, dass es ein elektrisch neutrales Molekül ist?

ladungslose Moleküle sind immer insgesamt elektrisch neutral, bzw. hat ein Molekül eine echte Gesamtladung steht die dran (SO4^2-. CL^-, H3O^+, SCN^-, etc.)

also mit + 1 + 1 + (-2) kann man doch so aufgrund der Partialladungen nicht erklären?

Qualitativ kann man das vielleicht vereinfacht irgendwie so machen, aber warum man das tun sollte leuchtet mir nicht ein, denn die tatsächliche Stärke der Partialladung kann so nicht beschrieben werden. Aber wie gesagt, das ist auch gar nicht nötig, die echte Ladung steht ja dran. So wie du/ ich das gemacht habe, haben wir so getan als wären die Partialladungen echte Ladungen, als wären die Bindungselektronen vollständig lokalisiert, was grob falsch ist, mach das bitte nicht in einem Test.

achso, ok. und hat H immer die Ladung +1? Weil bei den Ladungen gibt es soweit ich weiß, doch eine Ausnahme bei H, dass H immer die Ladung -1 hat? Oder liege ich da falsch?


Ich würde dir vorschlagen hier nicht von Ladungen, sondern von Oxidationszahlen zu sprechen, dann können wir das mit Zahlen machen. Wasserstoff hat in Verbindungen mit anderen Elementen immer die Oxidationszahl +1, außer in Alkalimetallhydriden, dort hat es die Oz -1.

Das sagt Dir doch die Symmetrie des Moleküls: Die beiden O-Atome sind gleichwertig

okay, aber manchmal wie bei der Verbindung von H - F haut die Symmetrie NICHT hin und dann heißt es statt kein Dipol, ein Dipol? Deswegen frage ich, wo man diese gestrichelte Linie genau hinzeichnen sollte, warum durch C?

Beim O=C=O gibt es eine Spiegelebene, die die beiden O-Atome vertauscht. Sie steht normal auf die Molekülachse, also verbietet sie ein Dipolmoment entlang derselben. Da das Molekül aber linear ist, kommt ein Dipolmoment in eine andere Richtung gar nicht erst in Frage, also hat CO₂ gar keines.
HF ist auch linear, aber es gibt keine solche Spiegelebene, die die linke Molekülhälfte in die rechte spiegelt. Daher kann ein Dipolmoment entlang der Molekülachse existieren.
okay, aber manchmal wie bei der Verbindung von H - F haut die Symmetrie NICHT hin und dann heißt es statt kein Dipol, ein Dipol? Deswegen frage ich, wo man diese gestrichelte Linie genau hinzeichnen sollte, warum durch C?