Chemie-Valenzstrichformel-Ozon?
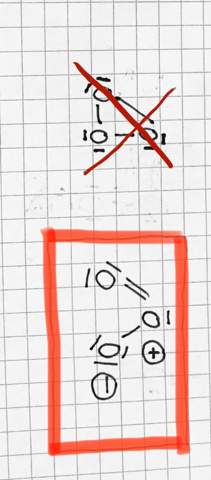
Warum ist meine Valenzstrichformel falsch, obwohl die 3 O-Atome auch den Oktettzustand erreichen? Warum sind dann Ladungen nötig?
danke :)
1 Antwort

Früher hatte man tatsächlich angenommen, dass die Dreiecksformel richtig ist, eben weil sie keine Formalladungen benötigt, und die stand auch noch in meinen Schulbüchern. Dass die tatsächlichen Bindungslängen zwischen O(1) und O(2), bzw. zwischen O(2) und O(3) aber nicht denen der "normalen" O-O-Einfachbindung entsprechen zeigt aber, dass diese Struktur nicht stimmen kann. Die tatsächliche Struktur ist diese:

Ein weiteres wichtiges Indiz dafür ist, dass Ozon ein permanentes Dipolmoment aufweist, was mit der Dreiecksformel nicht zu erklären ist. Das wird gut durch die Formalladungen deutlich. Wie du sehen kannst ist das mittlere Sauerstoffatom tendenziell leicht positiv geladen, was einfach nur bedeutet, dass seine lokale Elektronendichte geringer ist als die der benachbarten Sauerstoffatome.


Nicht ganz.
zu 1: Ja, deine Formel ist prinzipiell nicht unmöglich und naiv sogar wahrscheinlicher. Generell gilt: Je mehr Formalladungen, desto unwahrscheinlicher die Struktur und je mehr verschiedene mesomere Grenzstrukturen, desto stabiler das Molekül.
zu 2: Ein permanenter Dipol ist ein Molekül dann, wenn es innerhalb des Moleküls Regionen mit erhöhter und erniedrigter Ladungsdichte gibt. Für zweiatomige Verbindungen (HCl, H2O, etc.) kannst du dafür die Elektronegativität heranziehen.
Liegt die Elektronegativitätsdifferenz der Elemente über 0,5 und unter 1,7 ist das Molekül wahrscheinlich ein permanenter Dipol.
Allerdings ist eine große Elektronegativitätsdifferenz nicht hinreichend um zu bestimmen ob ein Molekül ein Dipol ist. Um das zu klären musst du dir die Geometrie anschauen.
dabei gilt: Ist ein Molekül symmetrisch aufgebaut z.B. CO2 oder BF3, ist es niemals ein permanenter Dipol.
Im Falle des Ozons stammt der Dipolcharakter daher, dass die beiden äußeren Sauerstoffe die Bindungselektronen jeweils gleichstark zu sich ziehen. Das mittlere Sauerstoffatom kann aber selbst nur so stark ziehen wie 1 Sauerstoffatom es eben kann. Dadurch verschiebt sich die Elektronenverteilung der O-O-Bindungen nach außen. Die äußeren Sauerstoffatome haben jetzt also eine leicht erhöhte Elektronendichte, während das mittlere Sauerstoffatom eine leicht erniedrigte Elektronendichte aufweist.
Das Dipolmoment des Ozons liegt dabei aber nur bei 0,5337 D, das ist sehr gering. Ozon ist also kein sonderlich starker Dipol. Wasser hingegen, um mal ein bekanntes Beispiel für einen starken Dipol zu nennen hat ein Dipolmoment von 6,152 D.

aber bei Ozon liegt ja doch aufgrund der Elektronegativität von 3,44 doch eine ionische Bindung und keine polare Atombindung vor?

Ozon ist keine zweiatomige Verbindung. Hier kannst du nicht mit der Elektronegativität arbeiten, das funktioniert hier nicht, weil alle Sauerstoffatome natürlich die gleiche Elektronegativität haben.

und wie kommt man darauf, dass es eine polare Atombindung ist, wenn man EN nicht berechnen kann?


und deswegen ist somit eigentlich auch meine Dreiecksformel falsch, da man die Ladungen hinzeichnen muss (aufgrund dem Dipolmoment)?

Im Grunde ja, aber ich glaube du solltest dich selbst noch einmal eingehend über Formalladungen informieren. Ozon ist einfach ein Beispiel dafür, dass die Messungen nicht immer mit der Theorie übereinstimmen. Wie gesagt, früher hatte man tatsächlich die Dreiecksstruktur angenommen, aber durch heutige Messungen der Eigenschaften des Teilchens weiß man mittlerweile, dass die einfachste Struktur eben nicht die richtige sein kann.
Zum einen hat man ein Dipolmoment gemessen, was die Dreiecksstruktur nicht erklären kann, zum anderen liegen die O-O-Bindungen längentechnisch irgendwo zwischen einer Einfach- und einer Doppelbindung, was ebenfalls gegen die Dreiecksstruktur spricht.
okay, also wäre meine erste Valenzstrichformel (das mit dem Dreieck) eigentlich nicht unbedingt falsch?
nur da man herausgefunden hat, das es diese Struktur (diese Dreiecksstruktur) so nicht gibt und es ein Dipol ist, müssen Ladungen dazu gezeichnet werden?
—> und ein Dipol ist es, weil man für das Zeichnen eines solchen Moleküls die Elektronegativität noch berechnet hat?
danke!