Chemie: Titration von Weinsäure mit Natronlauge?
Hallo liebe Community, ich habe eine Frage zur Titration von Weinsäure mit Natronlauge.
Weinsäure ist ja eine 2 protonige Säure, gibt also bei der Reaktion mit Natronlauge 2 Protonen (H+-Ionen) ab.
Die komplette Reaktionsformel lautet: 2NaOH + C4H6O6 -> C4H4O6Na2 + 2H2O
Die Reaktion läuft aber in 2 Teilreaktionen ab. Sprich, es wird erst 1 Proton und dann das andere abgegeben. Wie lauten denn diese beiden Reaktionen?
PS: Im Internet findet man nichts dazu. Ich brauche das für einen Chemievortrag in der Schule. Wäre echt hilfreich, wenn mir jemand die Reaktionsgleichungen sagen, beziehungsweise erklären könnte.
1 Antwort

Die beiden Teilgleichungen lauten:
C₄H₆O₆ + OH⁻ ⟶ C₄H₅O₆⁻ + H₂O (Hydrogentartrat)
C₄H₅O₆ + OH⁻ ⟶ C₄H₄O₆²⁻ + H₂O (Tartrat)
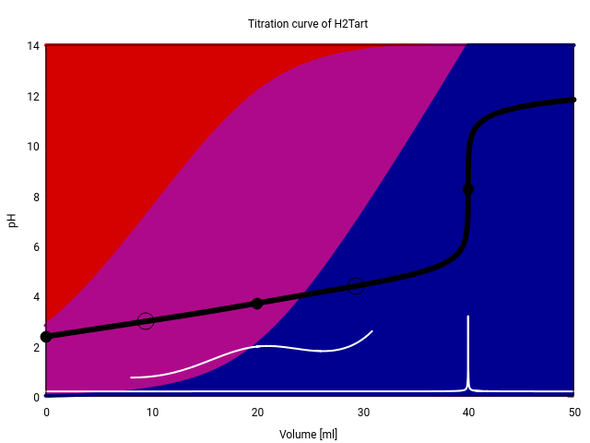
Hier siehst Du eine Titrationskurve von 20 ml einer 0.1 mol/l Weinsäure mit 0.1 mol/l NaOH. Die Titratioskurve (also pH in Abhängigkeit vom Verbrauch) ist schwarz, ihre erste Ableitung weiß eingezeichnet.
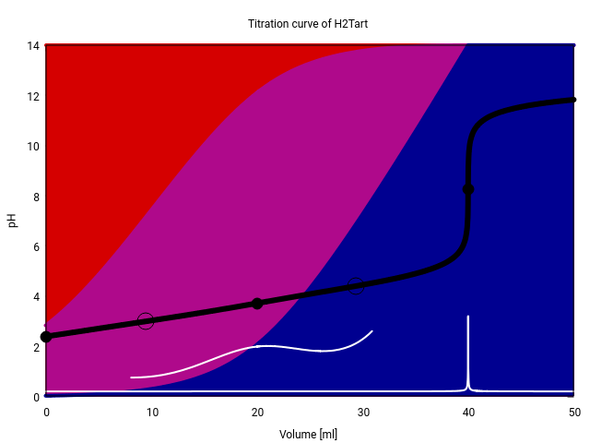
Die Weinsäure hat die pKₐ-Werte 2.99 und 4.40, und weil die recht eng zusammenliegen, finden die beiden Deprotonierungen nicht strikt hintereinander, sondern teilweise gleichzeitig statt. Das sieht man an den Hintergrundfarben am Bild: Am Anfang liegt hauptsächlich undissoziierte Weinsäure (rot), aber auch schon knapp 20% Hydrogentartrat (violett) vor. Noch ehe alle Weinsäure verbraucht ist, bildet sich bereits Tartrat (blau).
Dort, wo man den ersten Äquivalenzpunkt erwarten würde, liegen alle drei Spezies in anständigen Mengen vor; daher puffert die Lösung, und es tritt kein merklicher pH-Sprung auf. Erst der zweite Äquivalenzpunkt ist sichtbar, weil dort nur eine Spezies (Tartrat) vorliegt und die Lösung plötzlich die Pufferkapazität verliert, so daß der pH endlich springen darf. Wie Du siehst, wäre jeder Indikator geeignet, der zwischen 7 und 10 umschlägt.