Chemie lewis formel?
Hallo, ich wollte fragen, ob es bei der lewis Formel egal ist, wo man die Sachen platziert, so lange das Haar außen steht weil eigentlich haben wir alle gerade acht Außen Elektronen aber ich bin mir nicht sicher, ob das so geht

3 Antworten

Die Bindungsverhältnisse müssen stimmen! Also welches Atom mit welchem verbunden ist, ob's ne Einfachbindung oder Doppelbindung ist...
Es besteht aber eine gewisse Flexibilität darin, in welche Richtung du welche Bindung zeichnest. Wobei es auch da sehr hilfreich kann, wenigstens den Versuch zu machen die tatsächliche räumliche Anordnung des Moleküls abzubilden, weil man solche Lewis-Formeln natürlich nicht zum Spaß zeichnet, sondern weil man später was damit machen möchte... z.B. welche Elektronen sich welchem Teil des Moleküls annähern und da was machen können.
Deine gezeichnete Formel ist demnach falsch, weil sie nicht die korrekten Bindungsverhältnisse wiedergibt. Das H-Atom ist definitiv nicht am N gebunden und O-Atome machen keine Verkettungen, außer in der seltenen Ausnahme der Peroxide.
Als Hilfestellung: Das Nitrat-Ion NO3(-) ist ein ziemlich stabiles Ion, das immer mal wieder in der Form auftritt. Zeichne erst dieses Ion und denke dir dann ein H(+) hinzu, indem ein doppelt besetztes Orbital von einem O "ausklappt" und die Bindungselektronen zum H stellt.

Hallo,
das ist nicht egal, weil eine solche Verbindung aus Sauerstoff-Atomen mit Einfachbindungen instabil wäre und deshalb so nicht existiert.
Du brauchst eine Doppelbildung zwischen Stickstoff- und Sauerstoffatom, dann eine OH-Gruppe und noch eine vierte Bindung mit einem negativ geladenen Sauerstoff-Atom. Dieses Molekül ist dann, obwohl es eine Ladung gibt stabiler, weil die negative Ladung mesomeriestabilisiert ist.

Also du kannst dir merken, nie eine Kette an Sauerstoffatomen machen, sondern alle Sauerstoffatome um das Atom in der Mitte (hier Stickstoff) herumzeichnen und dann das Wasserstoffatom an eines der Sauerstoffatome hängen

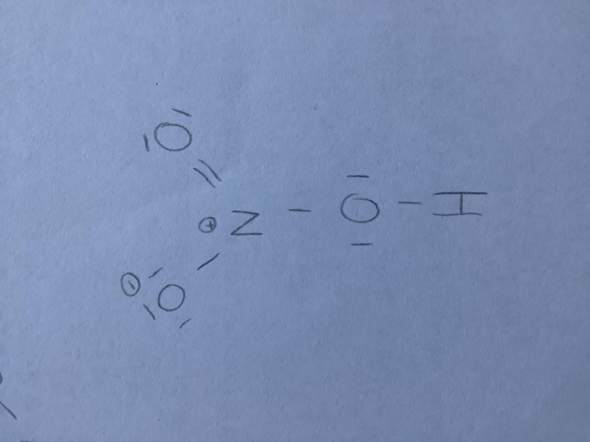
Die Lewis-Formel für HNO3 sieht wie folgt aus. Das hängt mit den Ladungen und Bindungsstärken zusammen. In der Schule muss man letztlich einfach hinnehmen und lernen, wie die Lewisformeln aussehen.
