Chemie diagramm gleichgewichtskonstante Ammoniaksynthese?
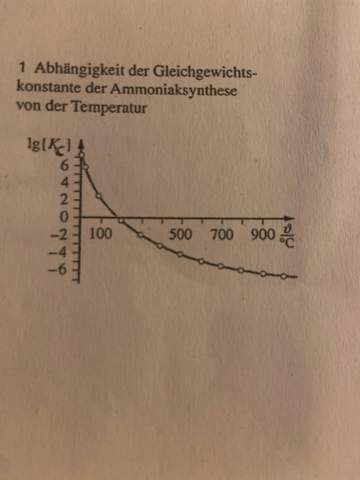
Ich schreibe ganz bald eine Klausur. Für diese muss ich ein diagramm beschreiben können und das mwg kennen usw. Ich hänge die ganze zeit an diesem übungsfiagramm. Natürlich erkenne ich das der graph nach unten geht mit steigender temperatur. Jedoch kann ichs einfach nicht ausführlich beschreiben. Ich kann keinen zusammenhang aufbauen. Kann mir da jemand weiterhelfen? Wir müssen das diagramm auch in endo- oder exotherm einordnen.
1 Antwort

Na ja, du hast Kc auf einer logarithmischen Skala gegeben. Bei Zimmertemperatur liegt die Gleichgewichtskonstante bei etwa 10^7, also ganz auf der Produktseite. Bei 500 °C liegt die Konstante bei etwa 10^-4, also weit auf der Eduktseite. Normalerweise formuliert man Gasgleichgewichte in Kp, das macht aber für die grundsätzliche Betrachtung keinen Unterschied. Als Verständnishilfe kann man die Wärme ins Gleichgewicht einbeziehen. Das ist aber nur eine didaktische Krücke und keine Klausurantwort! Bei einer exothermen Reaktion wird Wärme freigesetzt: 3 H2 + N2 -> 2 NH3 + Wärme. Eine Wärmezufuhr (=Erhöhung der Temperatur) verschiebt das Gleichgewicht in die Eduktrichtung - also genau das, was du im Diagramm observierst. Deine Reaktion ist also exotherm, das Gleichgewicht verschiebt sich in dem beschriebenen Temperaturbereich sehr deutlich von der Produkt- auf die Eduktseite.