Chemie Aufgabe?
Hallo,
Ich habe einige schwierigkeiten bei dieser Hausaufgabe, ich habe alles mögliche versucht doch komme nicht weiter. Es geht darum, das Aufstellen der Valenzstrichformeln anhand des Monophosphan-Moleküls (Verbindung aus Phosphor-und Wasserstoff-Atomen) in der richtigen reihenfolge zu erklären.
2 Antworten

Ich erkläre es meinen Tutoranden/Schülern immer wie folgt.
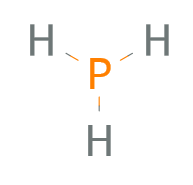
Zuerst packe das Atom, dass hier am wenigsten vorkommt, in die Mitte. Platziere dann um dieses (hier der Phosphor) die drei Wasserstoffatome.
Da Wasserstoff nur ein Valenzelektron hat, kann es maximal nur eine Einfachbindung eingehen. Also zeichnest Du drei Einfachbindungen vom H zum P
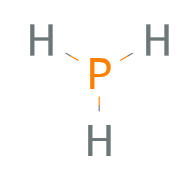
Aber irgendwas fehlt da noch, denn es scheinen Valenzelektronen zu fehlen.
Phosphor hat 5 und 3 kommen vom Wasserstoff macht in der Summe 8.
Jetzt schauen wir, wie viele Elektronen insgesamt gebraucht werden, um die Oktettregel (ohoh, ich fühle böse Blicke im Nacken) zu erfüllen.
Für Wasserstoff sind maximal 2 Elektronen und für Phosphor 8 Elektronen auf der äußeren Schale möglich. Das wären also 8+6=14 Elektronen. 14-8=6 es müssten also noch 6 Elektronen zugewiesen werden.
Drei mal zwei Elektronen gehen für die Einzelbindungen weg, bleiben noch 2 über.
Da aber Wasserstoff keine Elektronen mehr aufnehmen kann, wird Phosphor diese nehmen.
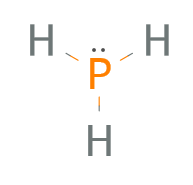
Fertig

Moin,
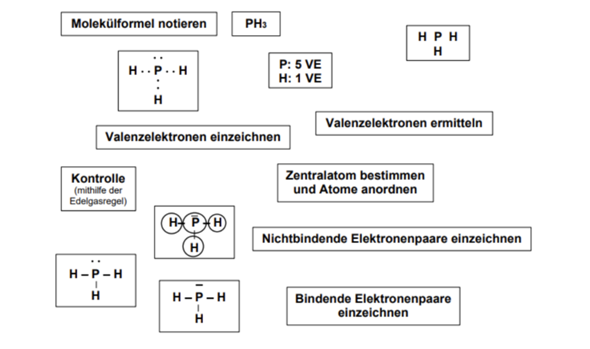
die richtige Reihenfolge in deiner Darstellung ist:
- Molekülformel notieren
- PH3
- Zentralatom bestimmen und Atome anordnen
- H P H (und unter P noch ein H)
- Valenzelektronen ermitteln
- P: 5 VE / H: 1 VE
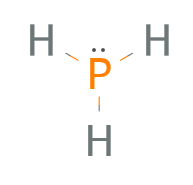
- H• •P• •H (und unter P noch ein H mit zwei Punkten dazwischen; über dem P gibt es auch noch einmal zwei Punkte)
- Bindende Elektronenpaare einzeichnen
- H–P–H (und unter P noch ein H mit einem Strich dazwischen; über dem P gibt es noch zwei Punkte)
- Nichtbindende Elektronenpaare einzeichnen
- H–P–H (unter unter P noch ein H mit einem Strich dazwischen; über dem P gibt es noch einen Strich)
- Kontrolle mit der Edelgasregel
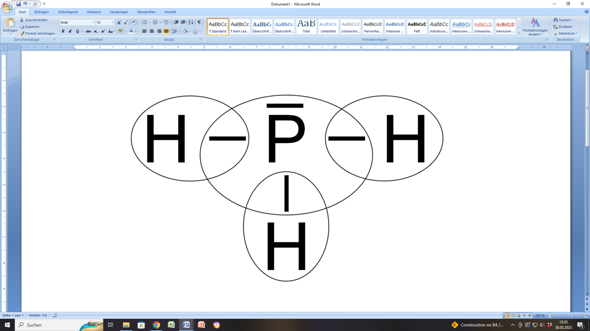
- und hier kommt das Kärtchen mit den Kreisen. Aber das ist in deiner Darstellung ungenau. Es müsste eher so aussehen:
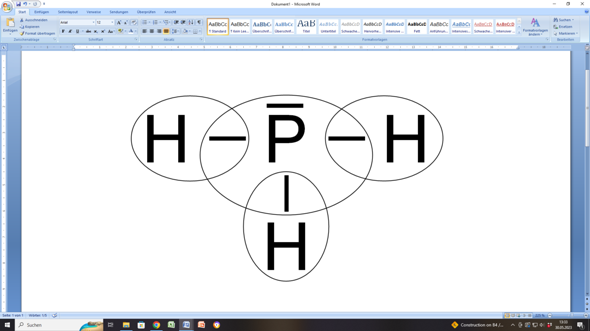
Denn die Ellipsen sollen ja zeigen, welches Atom welche Elektronen(paare) für sich beanspruchen kann.
Und in deiner Darstellung hätten die Hs nur ein Valenzelektron und das P fünf. Aber das wären keine Edelgaskonfigurationen.
In meiner Darstellung haben die Hs jeweils zwei Valenzelektronen (wie die Atome des Edelgases Helium) und das P hat acht Valenzelektronen (wie ein beliebiges anderes Edelgas, zum Beispiel Argon).
Alles klar?
LG von der Waterkant