Polykondensation: Säure + Alkohol ➡ Ester (Duroplasten)?
Ich lerne gerade fürs schriftliche Abi GK Chemie und es geht um Polymere.
Wir hatten ganz kurz das Thema angesprochen und ich weiß es müssen min. 3 funktionelle Gruppen geben. Wir haben es mit einen 3 wertigen Alkohol und einer 3 wertigen Carbonsäure besprochen.
Ich habe dafür in meine Unterlagen geguckt und bemerkt, dass es bei mir kein Ester gibt. Könnte mir deswegen einer ein duroplast zeigen, der aus den Edukten (Säure+Alkohol) entstanden ist? oder wenigstens bestätigen, dass dabei ein Ester entsteht? Oder liege ich jetzt ganz falsch?
3 Antworten

Deine Annahme ist richtig, dass ein Ester ensteht.
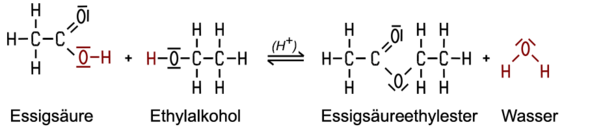
Hierbei können wir uns eine ganz einfach Reaktion angucken und zwar die von Ethansäure (Essigsäure) mit Ethanol (Ethylalkohol).
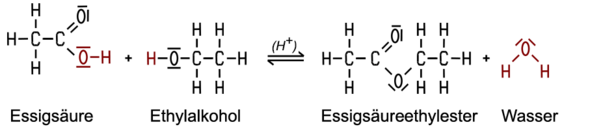
Wir sehen, dass Wasser abgespalten wird und ein Ester entsteht.
Die Estergruppe ist R1-COO-R2.
Nun gucken wir uns das ganze noch detaillierter an.
1)
Wir haben ein Ethansäuremolekül, welches ein Sauerstoffatom hat.
Das besagt Sauerstoffatom hat 6 Valenzelektronen, wovon 2 an der Doppelbindung mit dem C-Atom beteiligt sind und 4 weiter Valenzelektronen sind frei.
Bei der säurekatalysierten Esterbildung gelangt ein Proton (Wasserstoffkation) an das freie Elektronenpaar, wobei ein Elektron an das Wasserstoffkation abgegeben wird und somit hat das Wasserstoffkation wieder ein Elektron und es geht eine Bindung mit dem Sauerstoffatom ein, welches nun auch als Kation vorliegt, da es ein Elektron abgegeben hat.
2)
Da wir nun ein Sauerstoffkation haben, klaut sich der Sauerstoff ein Elektron aus der Doppelbindung zum C-Atom.
Nun haben wir hier ein C-Kation vorliegen, da ein Elektron entzogen wurde.
Wenn wir uns jetzt einen Alkohol angucken, bemerken wir, dass am Sauerstoffatom der Hydroxygruppe auch freie Elektronenpaare sind, wobei ein Elektron vom C-Atom geklaut wird und eine Bindung ausgebildet wird.
Nun haben wir ein Sauerstoffkation, welches in der Hydroxygruppe des Alkohols war.
3)
Da wir eine Hydroxygruppe haben, liegt am Sauerstoffkation noch ein Wasserstoffatom an, doch das Sauerstoffkation klaut sich dann das Elektron des Wasserstoffatoms, weswegen dieses als Proton (Wasserstoffkation) wieder abgespalten wird.
4)
Nun sind wir an dem Punkt angelangt, an dem wir am C-Atom der ehemaligen Carbonsäure zwei Hydroxygruppen haben und ein Sauerstoffatom, welches mit einem Alkylrest verbunden ist.
Diese tetraedrische Zwischenstufe ist aber sehr instabil.
5)
Glücklicherweise haben wir eine Säure als Katalysator, wobei ein Wasserstoffkation ein Elektronenpaar eines Sauerstoffatoms einer Hydroxygruppe angreift.
Somit haben wir auch wieder ein Sauerstoffkation, welches dem anliegenden C-Atom ein Elektron klaut, weswegen die Bindung aufgelöst wird und sich Wasser abspaltet.
Da nun ein C-Kation vorliegt, klaut das C-Atom ein Elektron des Sauerstoffatoms der anderen Hydroxygruppe, weswegen wieder ein Sauerstoffkation vorliegt.
Das Sauerstoffkation klaut hierbei das Elektron des Sauerstoffatoms und dabei wird dieses als Proton abgespalten und zurück bleibt unser Ester.
Die ganze Reaktion ist zudem reversibel.
~Johannes.

Hallo Merci2015,
die Polykondensation führt zu verschiedenen Polymeren.
Falls du Duroplaste oder Elastomere erzeugen willst muss mindestens eines der Monomere mehr als 2 reaktive Gruppen haben.

Hast Du schon mal von Polyester gehört?!? Jeweils zwei funktionelle Gruppen der Monomere bilden alternierend die Kette und mit der dritten können die Ketten miteinander verknüpft werden.